

从上世纪双抗概念提出以来,全球目前批准的双抗药物已有12款,其中首款上市药物Removab还因商业化原因在2017年退出市场。国内上市的双抗药物占据了其中的3款,分别是Amgen旗下靶向CD3/CD19的贝林妥欧单抗(Blinatumomab)、Roche旗下靶向IXa和X因子的艾美赛珠单抗(Emicizumab)以及首个国产双抗药物—康方生物旗下靶向PD-1/CTLA-4的卡度尼利单抗。
表1:全球及国内上市双抗药物(截至2023年7月)

资料来源:CPM新药研发监测数据库
中国医药工业信息中心
1. 卡度尼利单抗
(1)药物简介
卡度尼利单抗是首个完全由中国创新生物科技企业自主研发并获批在国内上市的肿瘤双免疫检查点抑制剂双抗,2022年6月29日获得NMPA批准用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗。它是康方生物利用Tetrabody双抗平台技术自主研发的新型的、首创的人源四聚体双特异性肿瘤免疫治疗药物,可同时靶向程序性细胞死亡蛋白1(PD-1)和细胞毒性T淋巴细胞相关蛋白4(CTLA-4)两个免疫检查点,来实现与肿瘤浸润性淋巴细胞的优先结合。
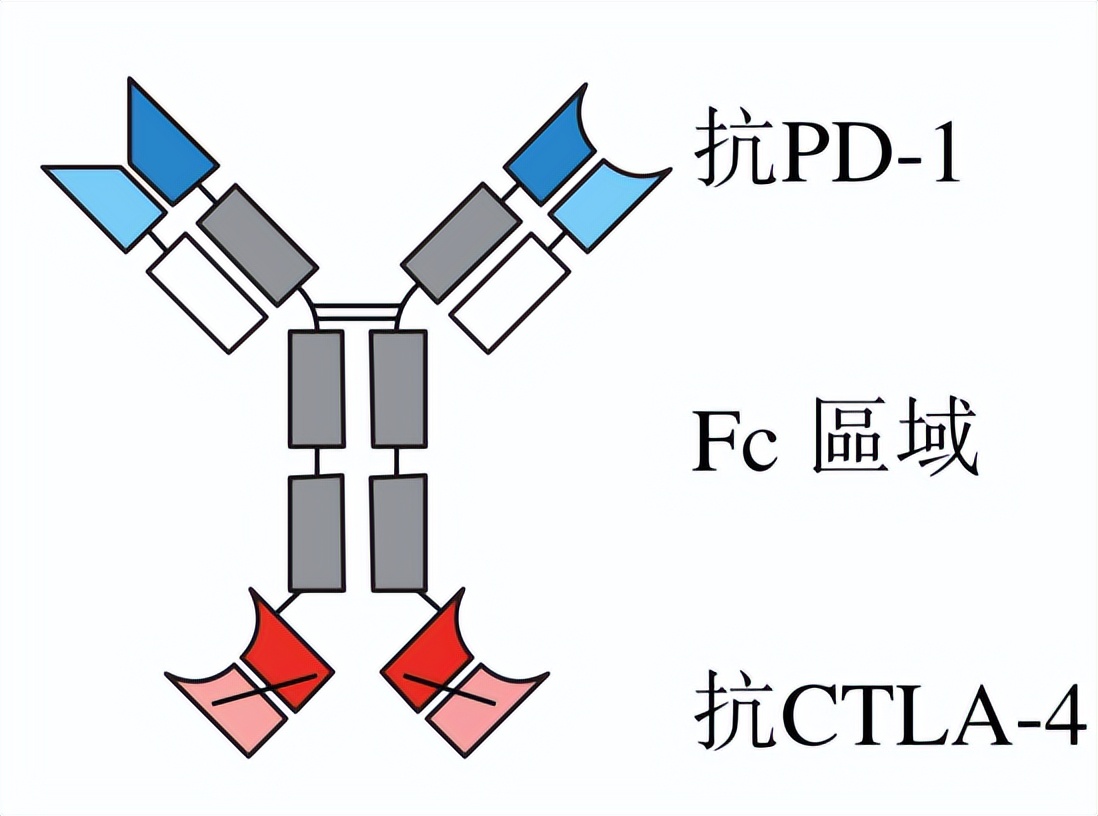
图1:卡度尼利单抗结构
数据来源:康方生物上市招股书
中国医药工业信息中心整理
PD-1与CTLA-4联合治疗的疗效已在黑色素瘤、胃肠癌和肾细胞癌的临床试验中得到证实,能够增加患者的反应率和生存率。然而,临床试验数据显示,PD-1与CTLA-4单抗联合疗法在增加抗肿瘤活性的同时,始终伴有大幅增加的剂量限制性治疗相关不良事件及毒性,这在一定程度上限制了联合疗法的临床应用。为了保留联合疗法的疗效,同时达到优于联合疗法的安全性,康方生物运用TETRABODY技术设计并研发了卡度尼利单抗。
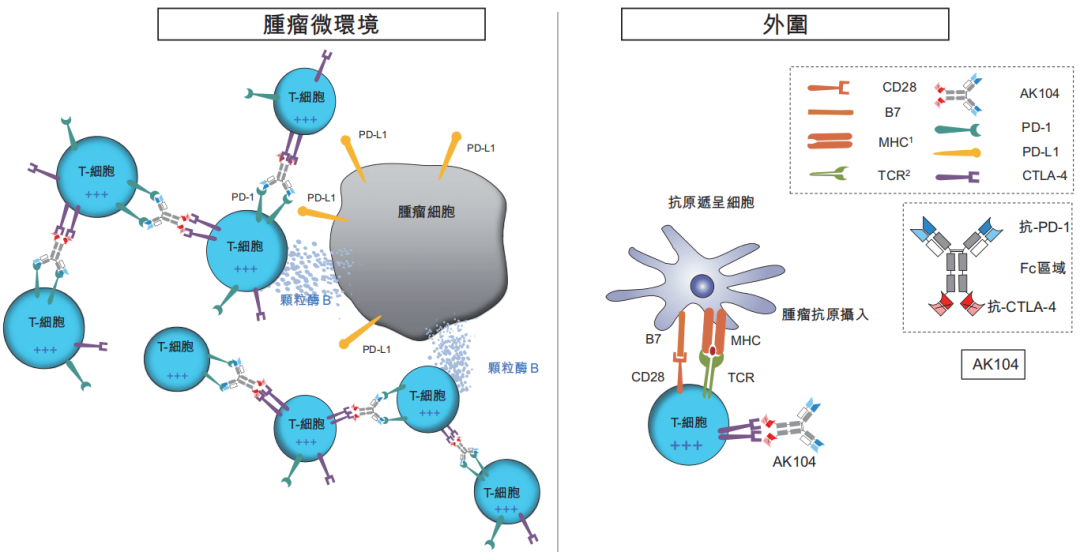
图2:卡度尼利单抗在肿瘤微环境和外周位点的亲和力表现
数据来源:康方生物上市招股书
中国医药工业信息中心整理
卡度尼利单抗的关键性三期临床试验结果显示,其治疗2L/3L宫颈癌的ORR(客观缓解率)为33.0%,CR(完全缓解率)为12.0%;对于PD-L1阳性患者ORR高达43.8%,CR高达17.2%,明显高于Balstilimab、Cemiplimabhe以及Balstilimab+Zalifrelimab联合疗法。
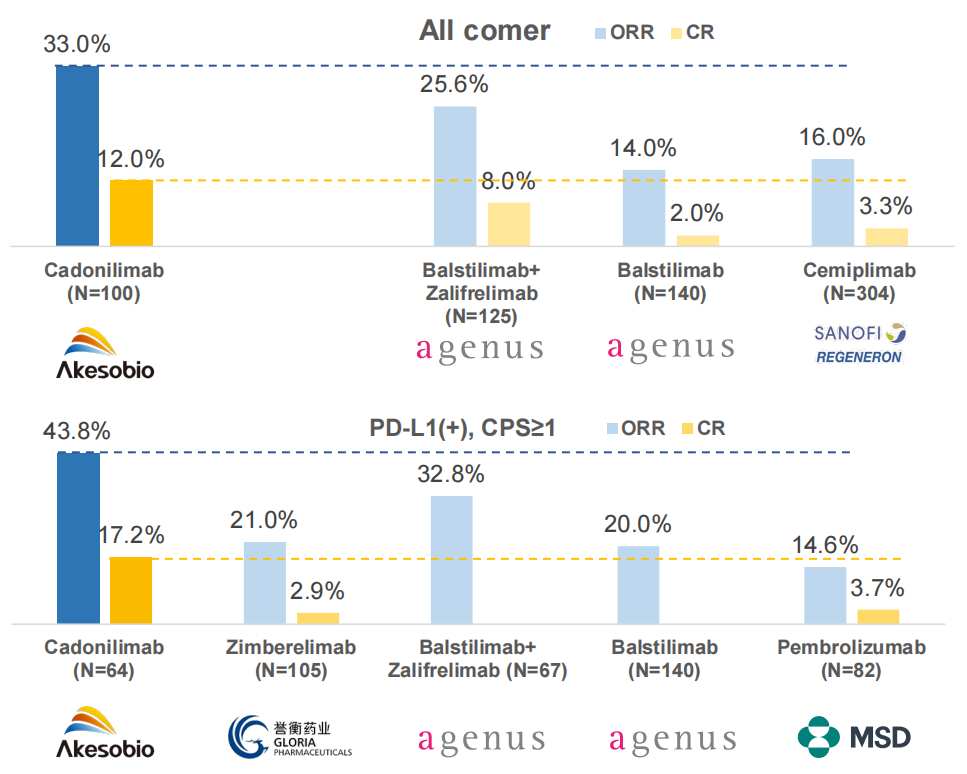
图3:卡度尼利单抗与其他药物治疗宫颈癌的临床数据对比
数据来源:康方生物2021年度报告
中国医药工业信息中心整理
(2)销售表现分析
宫颈癌是女性生殖系统中常见的恶性肿瘤之一,目前国内对于一线含铂化疗治疗失败的复发或转移性宫颈癌,无进一步的标准治疗方案。作为国内首个肿瘤免疫治疗药物,卡度尼利单抗未来的市场潜力巨大。目前其公布的价格为13,220元/瓶(125mg),首次用药3瓶,每两周给药,患者救助方案采取“3+2”模式,按照该定价和患者救助方案,卡度尼利单抗的年治疗费用不高于19.8万元人民币。截至2022年12月,卡度尼利单抗上市6个月即销售5.46亿元,充分展现出了冲击10亿级大单品的潜力。
2. 贝林妥欧单抗
(1)药物简介
贝林妥欧单抗最初由抗癌药物研发公司Micromet研发,2012年1月安进公司收购了Microme公司,获得了其开发权。基于III期临床试验结果,FDA于2014年12月批准了贝林妥欧单抗上市,用于治疗成人和儿童复发或难治性费城染色体阴性急性淋巴细胞白血病(ALL)和惰性B细胞淋巴瘤,成为全球第二个双抗药物,也是全球首个上市的BiTE免疫疗法。2015年该药物在欧盟地区被批准上市。从国内情况来看,2019年安进公司将贝林妥欧单抗的中国代理权给了百济神州。2020年12月,基于III期临床试验结果,该药在中国获批用于治疗成人复发或难治性前体B细胞ALL患者,并于2021年第三季度在国内上市。
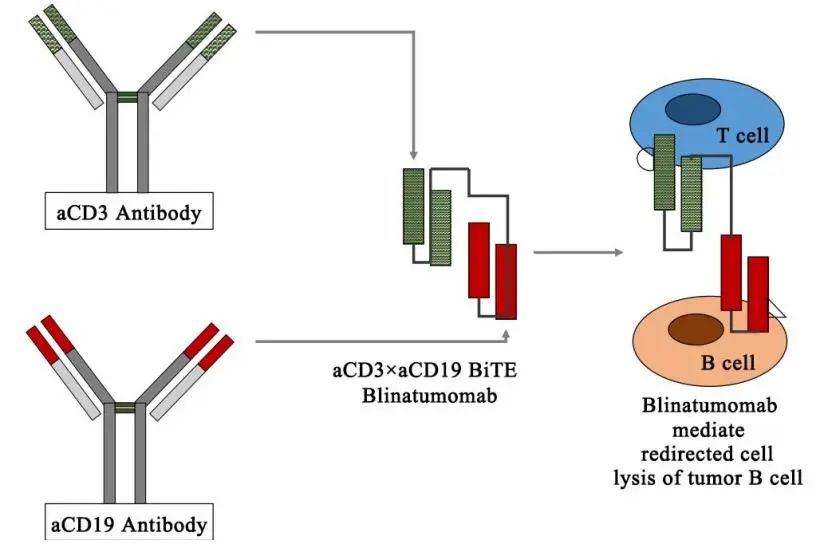
图4:贝林妥欧单抗的结构
数据来源:Bispecific antibodies for cancer therapy: A review
中国医药工业信息中心整理
贝林妥欧单抗(Blinatumomab)是基于安进的BiTE平台开发的靶向CD3和CD19的双抗。BiTE类分子能够通过刺激患者自身的T细胞与肿瘤细胞表面相关抗原结合,激活T细胞的细胞杀伤潜能,消灭肿瘤细胞。活化T细胞持续引发记忆T细胞的局部增殖,增强的多克隆扩增现象能继续有效的对抗癌细胞。
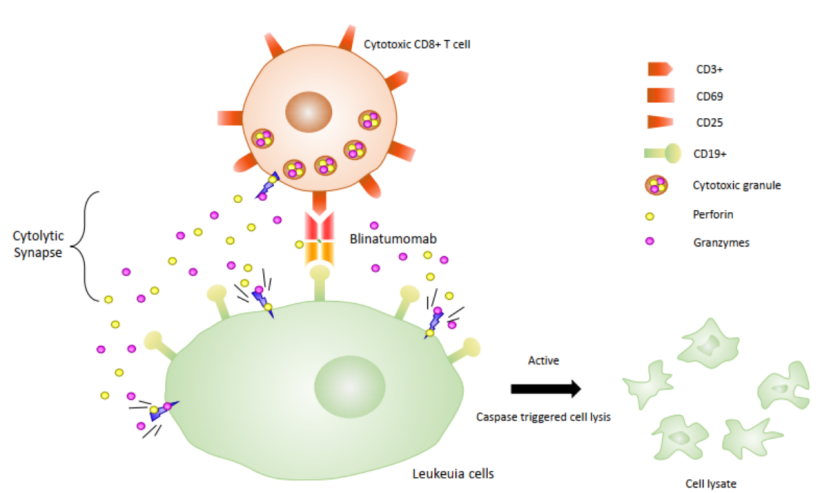
图5:贝林妥欧单抗的作用机制
数据来源:Design and Production of Bispecific Antibodies
中国医药工业信息中心整理
(2)销售表现分析
得益于其优异的临床治疗效果及持续的市场推广,贝林妥欧单抗自2014年12月上市以来,全球销售额稳定增长,年增速保持在20%-55%,从2015年的0.8亿美元增长到2022年的5.8亿美元,年复合增长率达24.3%。此外,贝林妥欧单抗于2021年第三季度在国内上市,2021年的销售额为1252万美元,2022年的销售额为3611万美元,涨幅达188.5%。但由于其价格较高(国内35g规格的参考售价在9000-12900元),昂贵的售价可能会降低贝林妥欧单抗的可及性。未来随着其进入医保,大幅降价后有望快速放量。
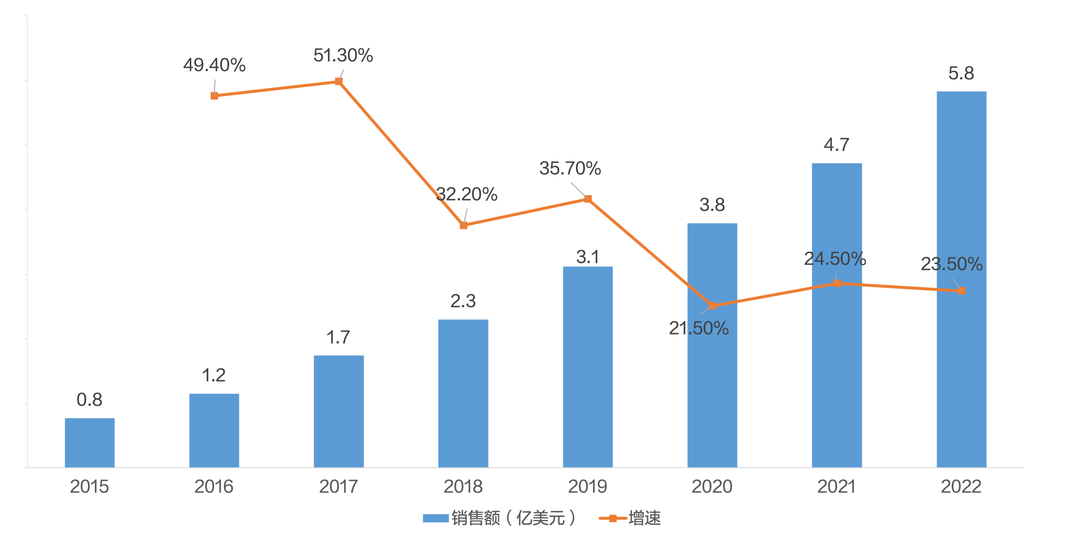
图6:2015-2022年贝林妥欧单抗全球销售额及增速
数据来源:安进2022年度报告
中国医药工业信息中心整理
3. 艾美赛珠单抗
(1)药物简介
艾美赛珠单抗(Emicizumab)是罗氏与Chugai联合开发的一款重组人源化的IgG4双抗。2017年11月,艾美赛珠单抗通过FDA优先审评上市,用于治疗含VIII凝血因子抑制物的A型血友病的出血预防治疗。2018年10月,FDA批准该药物用于常规预防或减少无VIII因子抑制物的A型血友病患者的出血发作频率。2018年11月,艾美赛珠单抗获得NMPA批准,用于存在凝血因子VIII抑制物的A型血友病患者的常规预防性治疗,成为国内批准的首个双抗药物。2021年5月7日,NMPA又批准该药用于不存在凝血因子VIII抑制物的重度A型血友病患者(先天性凝血因子VIII缺乏,FvIII<1%)成人及儿童患者的常规预防治疗。
艾美赛珠单抗通过重组DNA技术在中国仓鼠巢(CHO)细胞中制备,该抗体具有双抗结构,可桥接凝血因子IXa和凝血因子X,在体内模拟凝血因子VIIIa以实现A型血友病患者的凝血功能。同时,该药的分子结构类型与凝血因子VIII不同,因此不会诱导FvIII抑制剂或受FvIII抑制剂的影响。
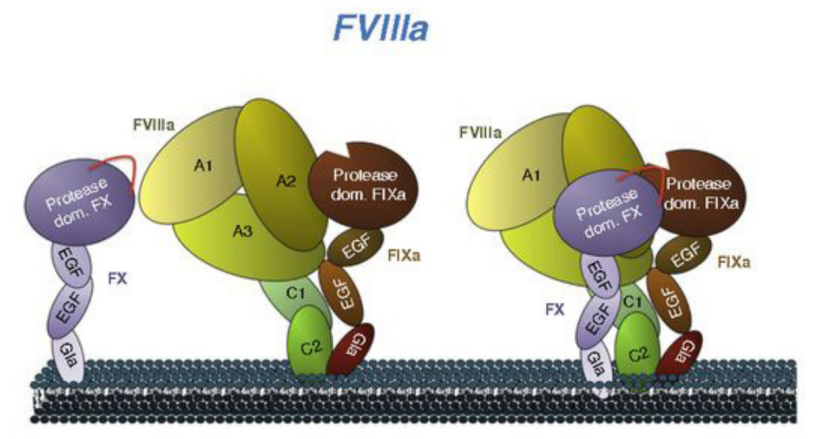
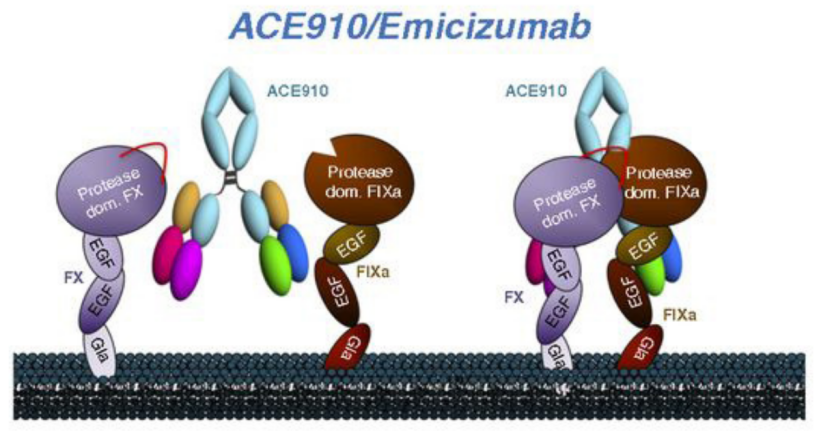
图7:FvIIIa和艾美赛珠单抗与酶和底物相互作用的差异
数据来源:Blood,中国医药工业信息中心整理
(2)销售表现分析
艾美赛珠单抗自2017年11月上市以来,全球销售额持续增长,之后得益于“无VIII因子抑制物的A型血友病”适应症的获批上市,该药的使用范围进一步扩大,其2019年销售额增速高达516.1%;2020年后保持稳定增长,增速保持在25%-60%,从2019年的13.8亿瑞士法郎增长到2022年的38.2亿瑞士法郎,年复合增长率达40.4%。此外,艾美赛珠单抗于2018年在中国上市,作为国内获批上市的唯一一款适用于A型血友病的预防治疗药物,2020年国内的销售额快速增长至2457万元人民币。但该药销售价格8,100元/30mg,对于体重60kg的患者来说年治疗费用高达120万元。目前该药仍由于价格因素而未能纳入医保目录,高昂的药价令患者“有药难及”。另外,国内只有一家公司独家销售,存在买药难和供应不及时的问题。由于血友病患者数量较少,治疗费用很高,因此可及患者数量十分有限,销售额增长缺乏动力。
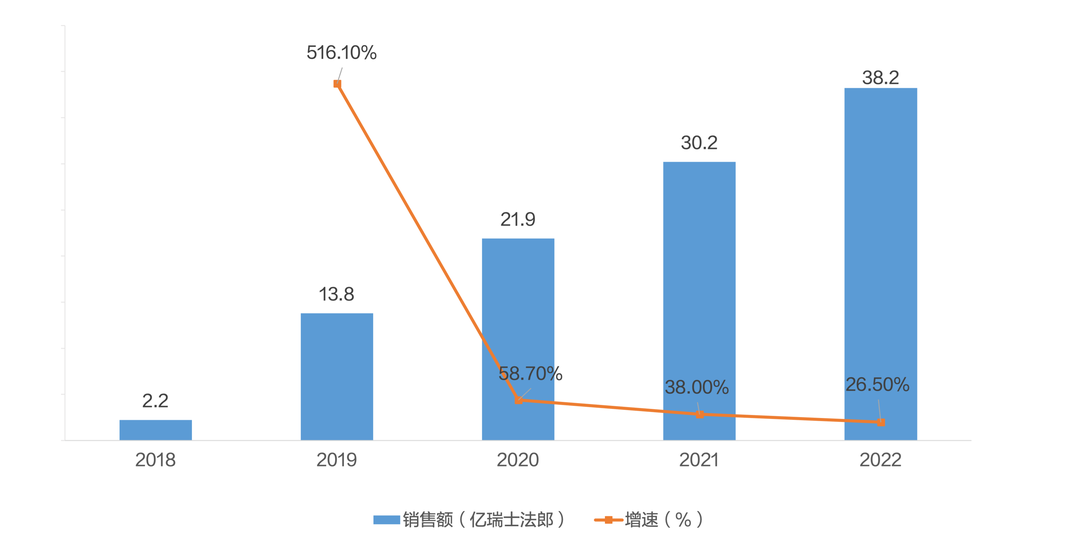
图8:2018-2022年艾美赛珠单抗全球销售额及增速
数据来源:罗氏2022年度报告
中国医药工业信息中心整理
SHINE CONSULTANT
上海士研管理咨询有限公司成立于2005年,长期致力于为组织领导者打造卓越的全球知识洞察与专家智库网络。依托近二十年的产业沉淀与经营积累,士研咨询汇聚了数百万名领导型企业的战略管理与决策者,聚焦于财管与资管、银行与保险、医药与医疗、出行与交通、零售与快消、文旅与传媒、能源与资源、国防与公用、高科技等关键产业和领域。公司目前拥有50余个品牌峰会项目,汇集了战略管理者所关注的关键议题,为企业和机构的产业性峰会活动提供一站式专业服务;此外,士研咨询为商业领导者搭建智库平台,为领导者的战略与决策提供全面、精确、高效的专家服务,为跻身全球一流的战略与管理顾问机构不断前行。同时,士研咨询致力于成为全球领先的2B营销服务机构,为客户提供一站式整合营销解决方案,助力企业线上线下获客与品牌筑造。
本文作者可以追加内容哦 !

