
昨日,Intellia Therapeutics公司(纳斯达克股票代码:$Intellia Therapeutics Inc(NASDAQ|NTLA)$)宣布,美国食品药品管理局(FDA)已经批准了该公司用于治疗转甲状腺素(ATTR)淀粉样变性伴心肌病的NTLA-2001的新药临床试验(IND)申请。NTLA-2001是一种基于CRISPR的体内基因编辑候选药物,其全球3 期研究预计将于2023年底启动,这将为美国首次开展体内基因编辑治疗的关键性研究铺平了道路。

这家由诺贝尔奖获得者Jennifer Doudna联合创办的生物技术公司尚未在美国开展过研究。美国临床试验数据库显示,Intellia在英国、法国、新西兰和瑞典进行的ATTR淀粉样变性治疗早期试验招收了全部72名患者。预计III期试验将与Alnylam公司开发的治疗同一种疾病的RNA疗法Amvuttra的试验类似。该研究在全球范围内招募了655 名患者,其主要终点是测量接受治疗与安慰剂治疗的患者因心力衰竭导致的死亡和住院等事件。

Intellia总裁兼首席执行官John Leonard博士说:“NTLA-2001的IND申请获得FDA批准后,我们就可以在美国启动关键的3期试验,这标志着首个基于CRISPR的体内候选药物开始进入后期临床开发阶段。这是Intellia和我们的合作方Regeneron迈出的又一重要步骤,我们的目标是建立治疗ATTR淀粉样变性的新标准。我们期待着在即将于11月9日投资者电话会议上分享有关3期研究的更多信息。”
Intellia的股票$NTLA周三上午下跌了3%。

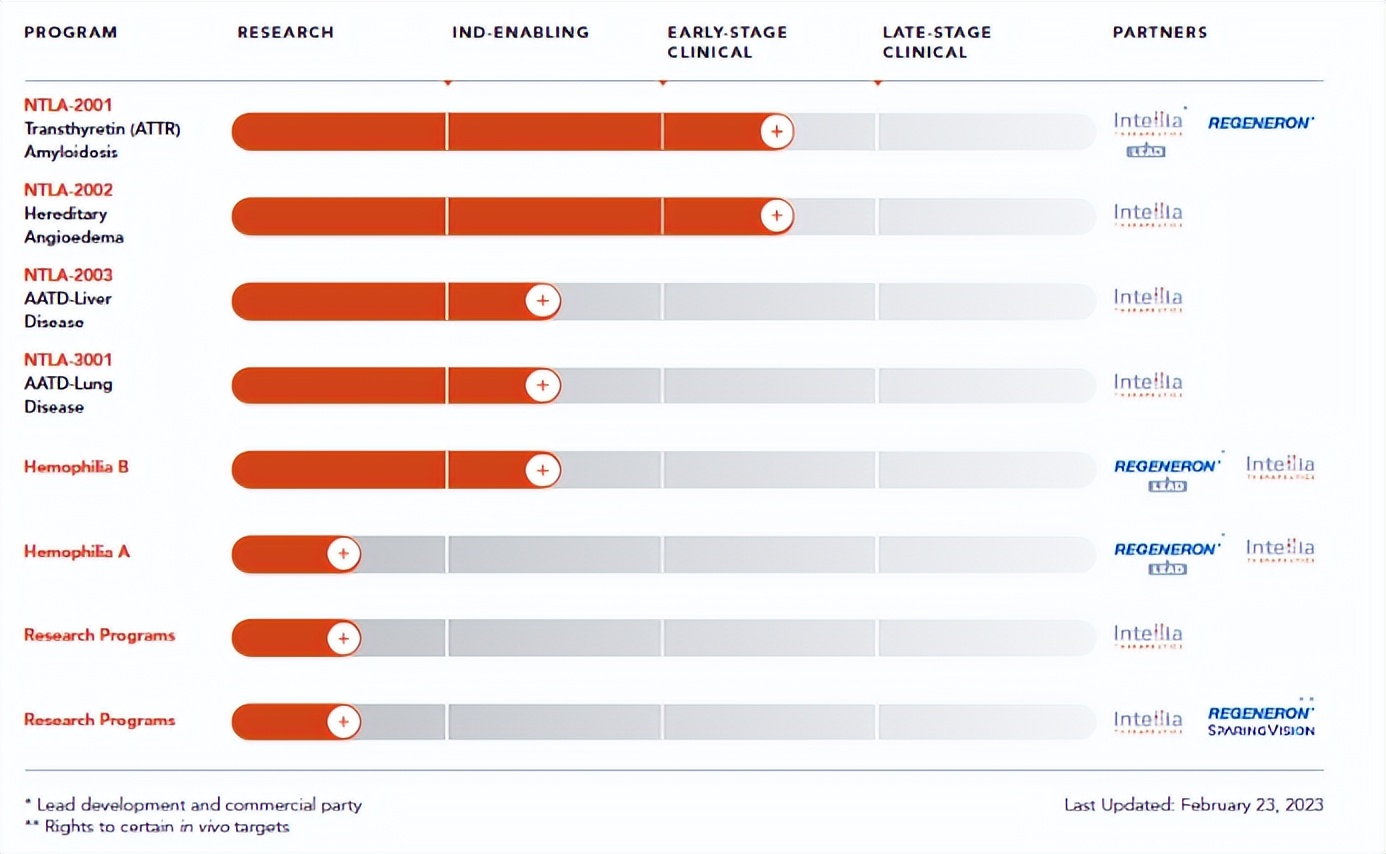
Intellia研发管线
关于 NTLA-2001
NTLA-2001以诺贝尔奖获得者CRISPR/Cas9技术为基础,有可能成为治疗ATTR淀粉样变性病的第一种单剂量疗法。NTLA-2001 是第一种通过全身给药或静脉注射来编辑人体内基因的 CRISPR 候选疗法。Intellia公司专有的非病毒平台利用脂质纳米颗粒向肝脏输送由两部分组成的基因组编辑系统:针对致病基因的特异性引导RNA和编码Cas9酶的信使RNA,Cas9酶负责执行精确编辑。
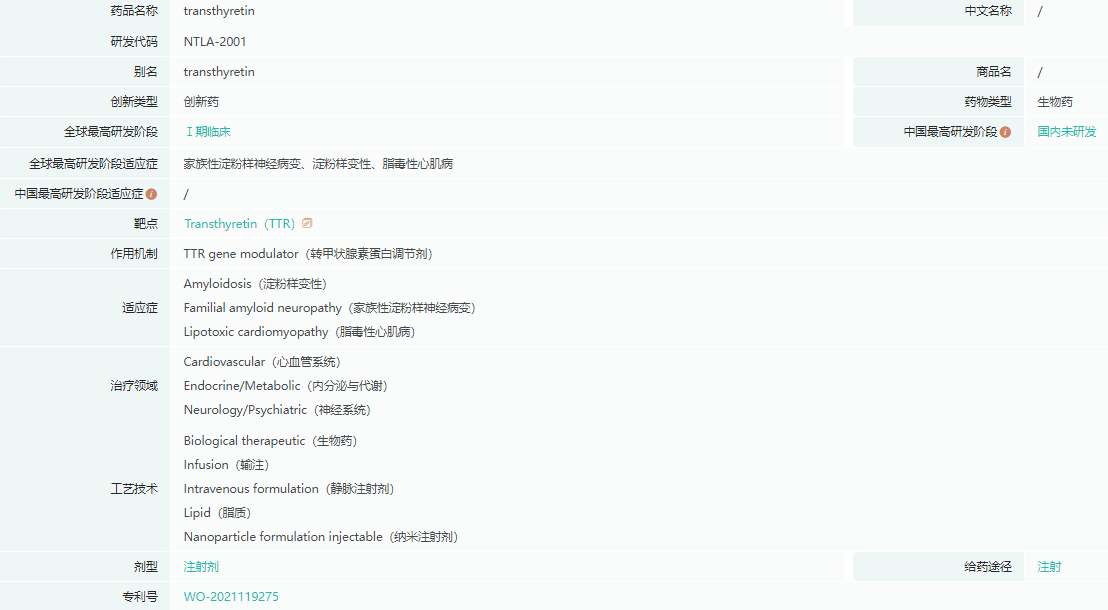
可靠的临床前和临床数据显示,体内靶基因失活后,转甲状腺素(TTR)会深度和持久地减少,这支持了NTLA-2001作为单次给药疗法的潜力。Intellia 主导 NTLA-2001的开发和商业化,这是与Regeneron开展的多靶点发现、开发和商业化合作的一部分。NTLA-2001的全球1期试验是一项开放标签、多中心、分两部分的研究,对象是患有遗传性转甲状腺素淀粉样变性伴多发性神 经病(ATTRv-PN)或转甲状腺素淀粉样变性伴心肌病(ATTR-CM)的成人患者。
<END>
本文作者可以追加内容哦 !

