11月24日,信达生物宣布,IBI351(KRAS G12C抑制剂)的新药上市申请(NDA)已获中国国家药品监督管理局(NMPA)药品审评中心(CDE)受理并纳入优先审评,用于治疗至少接受过一种系统性治疗的KRAS G12C突变型的晚期非小细胞肺癌患者。
IBI351是中国首个递交NDA的KRAS G12C抑制剂,有望尽早惠及KRAS G12C突变的肺癌患者。

此次NDA获受理并纳入优先审评是基于一项在中国开展的临床II期单臂注册研究结果。研究旨在评估IBI351单药在标准治疗失败或不耐受且携带KRAS G12C突变的晚期非小细胞肺癌受试者中的安全性、耐受性和疗效。注册研究结果计划在2023年欧洲肿瘤内科学会亚洲年会 (ESMO ASIA 2023)上公布。
此前,IBI351单药治疗晚期实体瘤患者的 I期临床研究结果在2023年美国癌症研究协会年会(AACR 2023)以口头报告形式公布。
结果显示,截至2023年2月10日,在67例非小细胞肺癌疗效可评估人群中,客观缓解率(ORR)为61.2%,疾病控制率(DCR)为92.5%。
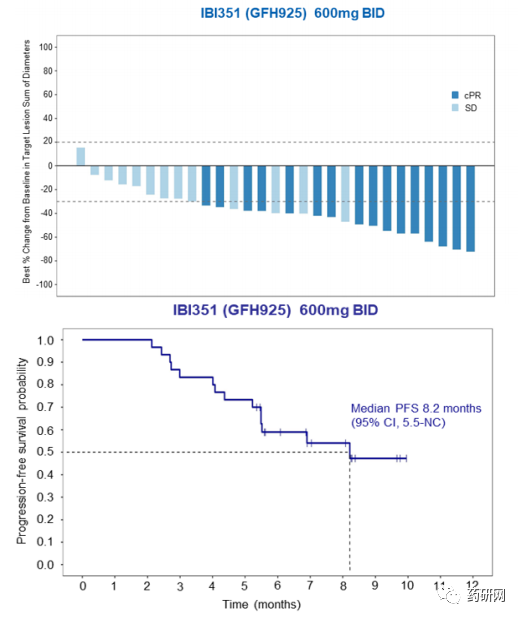
其中,600mg BID剂量组 (RP2D推荐剂量) 呈现更优的疗效,在30例可评估受试者中,ORR为66.7%(20/30),其中确认的客观缓解率(cORR)为53.3%(16/30)。DCR为96.7%。mDOR尚未达到,6个月DOR率为75.4%(95% CI, 39.8-91.7)。mPFS为8.2个月,PFS事件数为46.7%(14/30),6个月和9个月无进展生存率分别为58.9%(95% CI, 39.0-74.3)和47.3%(95% CI, 26.1-65.8),中位随访时间8.1个月,数据尚未成熟。
安全性方面,截至2022年11月30日,总体耐受性良好, 各剂量组未观察到剂量限制性毒性(DLT)事件,最大耐受量(MTD)未达到。共有94.0%(63/67)的受试者发生治疗相关不良事件(TRAEs),大部分为1-2级,最常见的TRAE为贫血、瘙痒、转氨酶升高、乏力、蛋白尿和胆红素升高。31.3%的受试者发生3级以上TRAEs,无导致治疗终止或死亡的TRAEs发生。
信达生物也在探索IBI351组合疗法用于前线治疗的潜力,两项Ib期临床研究在进行中,分别为IBI351联合爱必妥(西妥昔单抗注射液,EGFR单抗)、IBI351联合达伯舒(信迪利单抗注射液,PD-1抑制剂),用于治疗携带KRAS G12C突变的晚期非小细胞肺癌。
除此之外,IBI351单药治疗在晚期结直肠癌后线治疗中初步显示出优异的疗效和良好的安全性,最新研究结果在2023年美国肿瘤学会(ASCO)大会上发布,并于2023年5月被CDE纳入突破性治疗品种,拟用于治疗至少接受过两种系统性治疗的KRAS G12C突变型的晚期结直肠癌患者,成为国内首个纳入突破性治疗药物、治疗晚期结直肠癌的KRAS G12C抑制剂。
关注wechat药研网
本文作者可以追加内容哦 !


