细胞疗法攻克实体瘤,用了多少年?答案是:35年。
2024年2月16日,Iovance的TIL疗法AMTAGVI™(Lifileucel)获得FDA加速批准,适用于先前已接受PD-1阻断抗体治疗的不可切除或转移性黑色素瘤成人患者,正式结束35年研发长跑,成为首款且唯一一款获得FDA批准,用于治疗实体肿瘤癌症的一次性、个体化T细胞疗法产品。
这意味着,细胞疗法取得了历史性突破。受此利好消息刺激,Iovance在2月20日收盘大涨31.48%,总市值达到30.79亿美元。
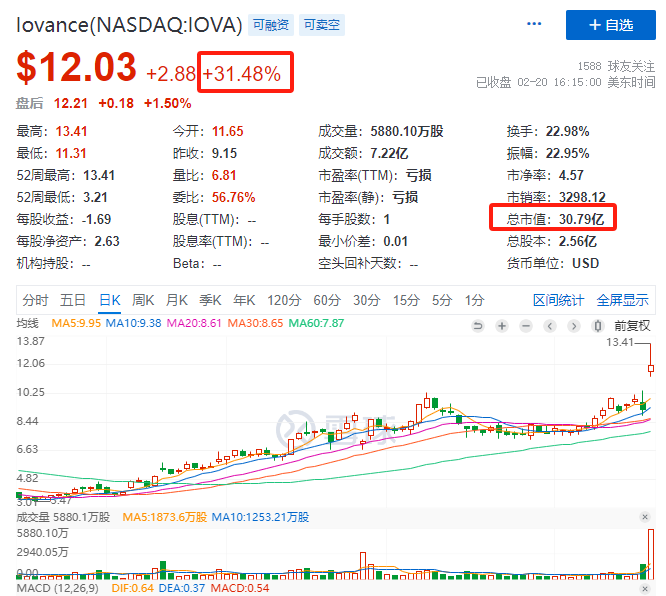
Iovance股价表现 图片来源:雪球
除此以外,另一个细胞疗法细分赛道也取得了里程碑式的发展。
2024年1月31日,Adaptimmune的TCR-T疗法Afami-cel的上市申请获FDA受理并授予优先审评资格,PDUFA日期为今年8月4日。若能顺利获批,Afami-cel将成为首款用于治疗实体瘤的TCR-T疗法。
毫无疑问,细胞疗法的实体瘤时代已经到来!
01
TIL疗法为何能攻克实体瘤?
免疫细胞疗法是以功能性细胞为主体的治疗方法,将以T细胞为主的免疫细胞注入患者以消灭体内癌细胞。
免疫细胞疗法具有多种细分类型,既包括已批量上市的嵌合抗原受体T细胞免疫疗法(CAR-T),也有TCR转导T细胞(TCR-T)、肿瘤浸润淋巴细胞(TIL)、自然杀伤(NK)细胞疗法。
其中,CAR-T疗法的成药性已得到市场充分验证,目前全球共有10款CAR-T疗法获批上市,但都是针对血液瘤领域,市场空间有限,且靶点集中在CD19和BCMA,获批适应症多为B细胞性白血病和淋巴瘤、多发性骨髓瘤和T细胞性血液系统恶性肿瘤。
为了突破市场天花板,CAR-T疗法一直在尝试攻克实体瘤,但由于面临靶点缺乏、无法有效浸润肿瘤组织等诸多挑战,至今仍未修成正果。

不同类型的免疫细胞疗法,机制也有所不同。
虽然CAR-T和TIL疗法都是利用患者自身的T细胞来攻击癌细胞,但TIL疗法治疗实体瘤的优势更加明显。
CAR-T疗法的机制,是从患者血液中提取T细胞,并进行基因工程改造,使它们能够识别癌细胞表面的特定抗原。然而,由于某些实体瘤的抗原可能并不明显或与健康细胞相似,增加了CAR-T细胞误攻健康细胞的风险。
相较之下,TIL疗法采用了不同的策略,其细胞来源于从患者实体瘤中提取的已经浸润肿瘤的T细胞(即肿瘤浸润淋巴细胞,TIL)。这些TIL经过体外活化和扩增后,数量增多并更具攻击性,在回输患者体内后,会在体内寻找并消灭肿瘤。
由于TIL是从肿瘤内部提取,更能识别癌细胞表面的特异性新抗原,从而更准确地定位并攻击肿瘤,且减少了对健康细胞的伤害。因此,在实体瘤治疗方面,TIL疗法相对CAR-T疗法更具优势。
02
为实体瘤而生?
Lifileucel的成功获批,既诞生了全球首款TIL疗法,也让细胞疗法取得了攻克实体瘤的里程碑式成果。
此次Lifileucel获批的适应症,为PD-1/PD-L1治疗后进展的晚期黑色素瘤。
黑色素瘤是一种特殊的实体肿瘤,是黑色素细胞来源的一种高度恶性的肿瘤,多发生于皮肤,也可见于黏膜和内脏,约占全部肿瘤的3%。
资料显示,全球每年约有32.5万新发黑色素瘤患者,其中每年约有5.7万患者因该病死亡;美国每年约有10万人被诊断出患有黑色素瘤,约有7700人死于该疾病。
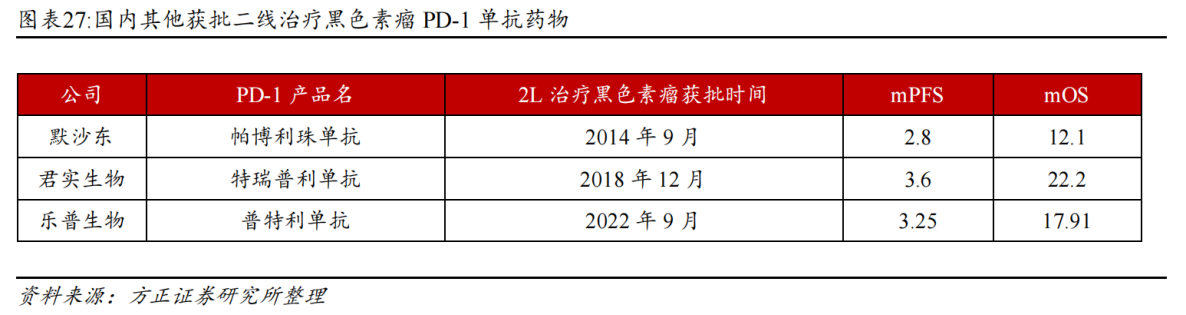
目前,全球已获批二线治疗黑色素瘤的PD-1单抗,包括默沙东的帕博利珠单抗、君实生物的特瑞普利单抗和乐普生物的普特利单抗等,其中特瑞普利单抗的数据较为亮眼,中位无进展生存期(mPFS)为3.6个月,中位总生存期(mOS)为22.2个月。
Lifileucel之所以能获FDA加速批准上市,正是基于良好的疗效。
根据关键临床结果C-144-01显示,针对晚期(不可切除或转移性)黑色素瘤适应症,2022年5月公布的Cohort 4(n=87)中,ORR为29%,其中3例完全缓解,22例部分缓解;DOR为10.4个月,中位随访时间为23.5个月;截至2023年6月16日,中位随访时间为48.1个月,4年的OS为22.2%,最长的反应持续了59.9个月,一次性给药的Lifileucel显示出了持久的疗效。
另外,2023年10月公布的12名晚期粘膜黑色素瘤患者治疗结果显示:ORR为50%,在中位数为35.7个月的研究随访中,中位OS为19.4个月,安全性良好。
TIL疗法在实体瘤治疗上的优势,让全球不少药企纷纷入局。
目前全球已有超过15款TIL疗法进入临床研究阶段,进度上多处于临床Ⅰ期或Ⅱ期阶段,开发的适应症除黑色素瘤外,还有非小细胞肺癌、头颈癌、乳腺癌和结直肠癌等实体瘤。
如此丰富的癌症类型,仿佛TIL疗法就是为实体瘤而生一般。
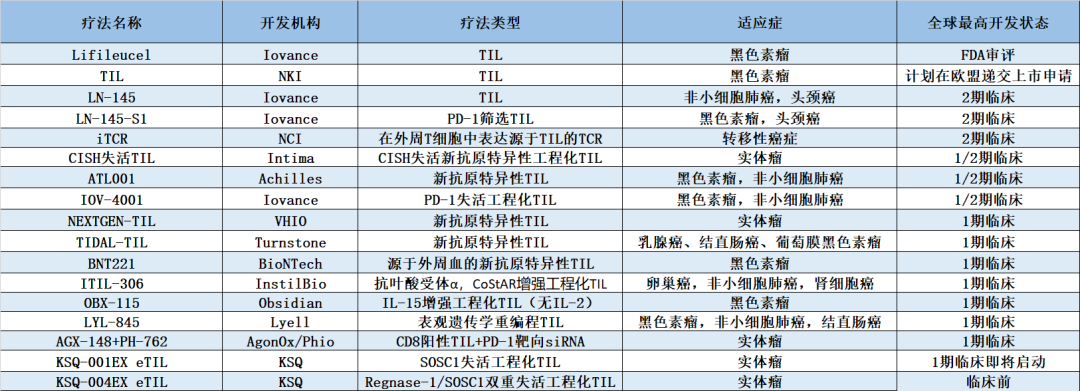
部分在研TIL疗法 数据来源:药明康德内容团队制图
国内市场方面,一些布局TIL疗法的国产企业,在一级市场受到了资本的青睐,包括沙砾生物、启生物科技、原启生物等都获得了超亿元融资。
例如,沙砾生物官网显示,共有6款TIL疗法在研发当中,其中5款针对实体瘤,涉及宫颈癌、肺癌和巢癌等各个癌种;原启生物也布局了多款针对实体瘤的细胞疗法管线。
不仅仅是研发端,由于个性化治疗的独特性,制备工艺优化、缩短制备时间和改造优化策略等,也是当下TIL疗法需要解决的关键问题。
值得一提的是,医药外包龙头$药明康德(SH603259)$与Iovance已就TIL创新疗法AMTAGVI™(lifileucel)达成了近10年合作。
2月20日,药明康德旗下专注于细胞和基因疗法的CTDMO药明生基宣布,FDA已批准其费城基地进行AMTAGVI的分析测试和生产。
此次获批,标志着药明生基费城基地成为美国首个获得FDA批准用于支持实体瘤个体化T细胞疗法商业化生产和放行的外部生产基地和第三方合同测试、开发和生产组织(CTDMO)。
03
攻克实体瘤进行时
除TIL疗法外,TCR-T和CAR-T疗法等其他细胞疗法,也一直在尝试攻克实体瘤。
就目前进度而言,下一个突破实体瘤治疗困境的细胞疗法细分赛道,大概率将会花落TCR-T疗法。
2024年1月31日,Adaptimmune宣布TCR-T疗法Afami-cel的上市申请获FDA受理并授予优先审评资格,如无例外将于今年8月14日前获FDA批准上市,成为首款用于治疗实体瘤的TCR-T疗法,用于治疗滑膜肉瘤。
资料显示,滑膜肉瘤是一种软组织肿瘤,最常发生于四肢关节旁,也可发生于前臂、大腿、腰背部的肌膜和筋膜上。如果Afami-cel能顺利获批,将成为10多年来治疗滑膜肉瘤的首个有效疗法。
在实体瘤治疗方面,TCR-T疗法也展现出了明显的优势。
不同于无法有效浸润肿瘤组织的CAR-T疗法,TCR-T识别抗原主要依赖MHC递呈,使其可靶向抗原范围更广,不受细胞表面抗原的限制,同时也能更好的浸润实体瘤。由此,全球不少药企抢滩入局TCR-T疗法。
目前全球在研的TCR-T疗法,布局靶点主要为在实体瘤中广泛表达的癌-抗原(CTA)家族,如MAGEA4、NY-ESO-1等,例如Afami-cel正是靶向MAGEA4抗原;针对适应症,包括肝癌、、巢癌和非小细胞肺癌等。
尽管屡战屡败,CAR-T细胞疗法仍未放弃突破实体瘤桎梏。
如今,CAR-T疗法已不再扎堆于CD19、BCMA两个血液瘤热门靶点,而是在实体瘤适应症上布局丰富靶点,包括胃癌明星靶点Claudin18.2、肝癌免疫治疗明星靶点GPC3、肠癌潜在靶点GCC和小细胞肺癌热门靶点DLL-3等。
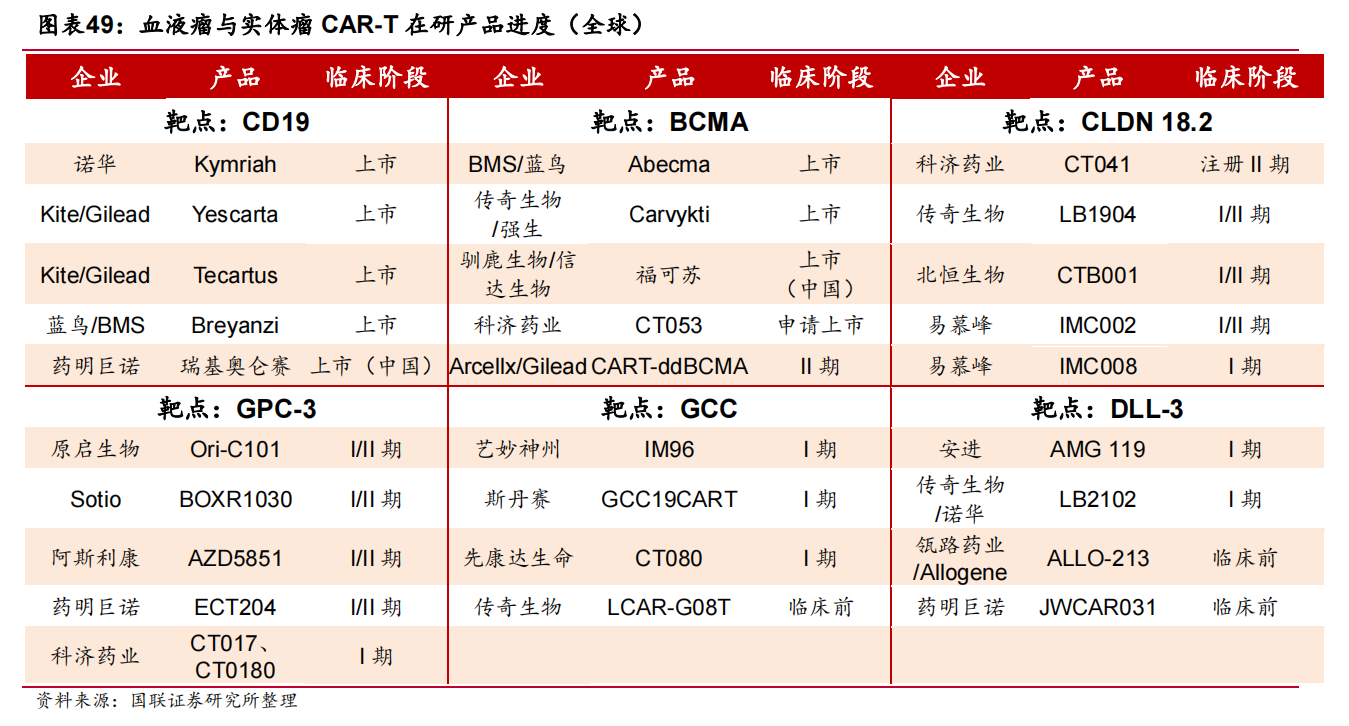
例如,$科济药业-B(HK|02171)$CT041、传奇生物LB1904,均是靶向Claudin18.2。其中,CT041在胃癌或治疗上展现出了亮眼的效果。
根据科济药业在2024 ASCO GI公布CT041治疗CLDN18.2阳性晚期胃/胃食管交界处癌(G/GEJC)或(PC)患者的Ib/II期研究(NCT04404595)结果:在GC/GEJ组中,ORR为42.9%(3/7),DoR中位数为6.9个月,CBR为57.1%;在PC组中,ORR为16.7%(2/12),DoR中位数为3.4个月,CBR为33.3%。
除此以外,靶向GPC3的在研CAR-T疗法,包括$药明巨诺-B(HK|02126)$ECT204、科济药业CT017等;靶向GCC的在研CAR-T疗法,包括艺妙神州IM96、斯丹赛GCC19CART等;靶向DLL-3的在研CAR-T疗法,包括安进AMG 119、诺华向传奇生物引进的LB2102等,期待后期读出更多亮眼数据。
看好细胞疗法在实体瘤领域市场前景的,不乏安进、诺华等跨国制药巨头。
例如,2023年11月,传奇生物将LB2102的全球权益授权给诺华,后者将支付1亿美元首付款,以及总计达10.1亿美元的临床、监管和商业化里程碑以及净销售额高个位数至低十位数的销售分成。
04
结语
经过数十年的等待,细胞疗法终于打破了实体瘤治疗的难题。Lifileucel的获批,标志着细胞疗法正式踏入了实体瘤治疗的新纪元。
然而,这只是漫漫征途的起点,细胞疗法在攻克实体瘤的道路上仍有许多挑战等待克服。
参考资料:
1.各家公司财报、公告、官网
2.《20230515-生物医药行业深度报告:创新生物药械板块年中策略,关注创新板块Q2后景气度上行》,东北证券
3.《35年长跑!潜在治愈实体瘤,这款细胞疗法迎来关键里程碑》,药明康德,2023-12-16
#冲击3000点未果!A股缘何冲高回落?#
本文作者可以追加内容哦 !

