5月22日,Biogen宣布收购Human Immunology Biosciences(HI-Bio™)。根据协议,渤健将支付11.5亿美元预付款和高达6.5亿美元的潜在里程碑款项。
HI-Bio
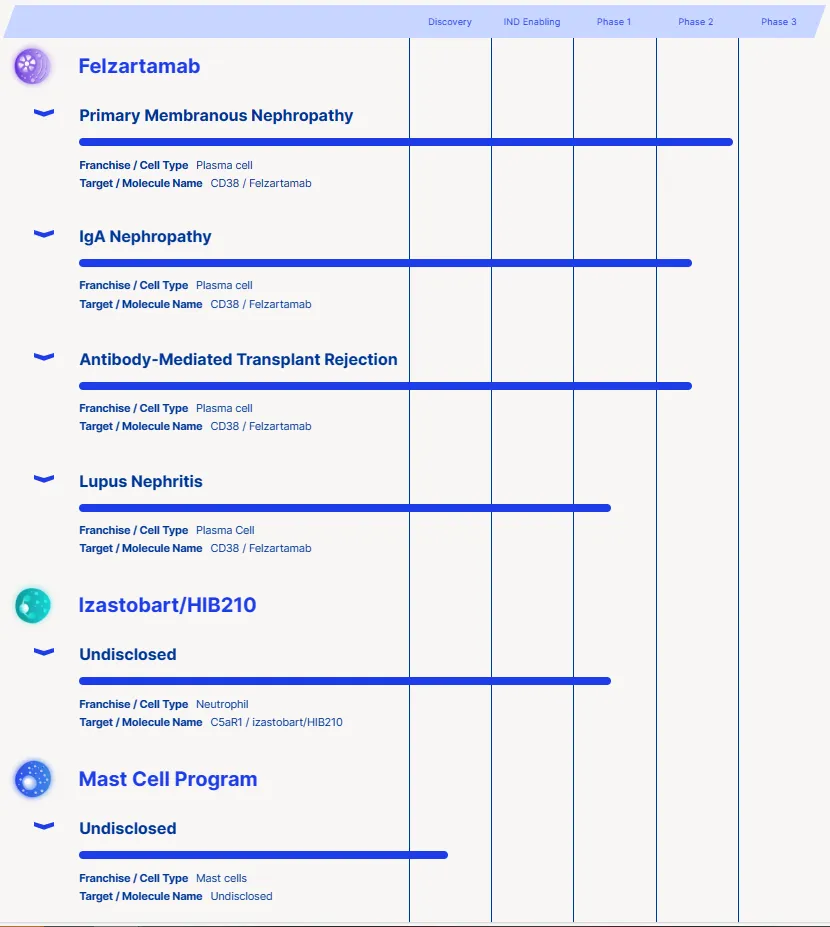
HI-Bio专注于精准医疗方法,为免疫介导性疾病(IMD)领域开发免疫疗法,其线中主要资产felzartamab是一种全人源抗CD38单克隆抗体,正在开发用于多发性骨髓瘤(MM)、原发性膜性肾病(PMN)、抗体介导的排斥反应(AMR)、IgA肾病(IgAN)等多个适应症的临床研究。
Felzartamab已获得FDA的突破性疗法认定(BTD)用于治疗PMN,并已获得孤儿药认定(ODD)治疗AMR。
目前,Felzartamab用于治疗PMN和治疗AMR的 2 期研究已经完成,IgA 肾病(IgAN)的 2 期研究仍在进行中,HI-Bio 计划将每个适应症推进到 3 期。
HI-Bio计划在即将于欧洲肾脏协会大会上提交两份摘要,包括肾移植患者AMR研究的完整2期数据和2期IgAN研究的中期数据。Felzartamab 在 AMR、PMN 和 IgAN 适应症方面具有临床数据。
Biogen计划利用其罕见疾病能力来开发和商业化此款CD38单抗,将保留旧金山 HI-Bio 的专业团队,并建立一个专注于免疫介导疾病的团队。
此次收购进一步扩大渤健的产品管线组合,后期若能在临床取得成功,将显著扩大其在免疫学领域的影响力。
天境生物拥有中国权益
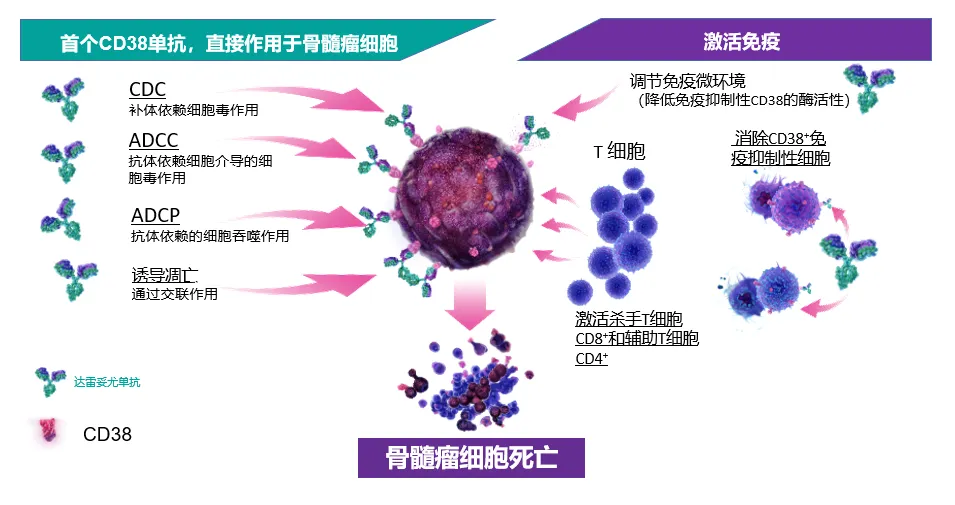
Felzartamab原由MorphoSys开发,2017年11月,天境生物从MorphoSys获得了CD38单抗菲泽妥单抗(TJ202/MOR202)在我国的独家开发和商业化权益。
2022年6月,天境生物宣布,其已完成菲泽妥单抗治疗三线MM的注册性临床试验,并已完成二线MM的III期临床试验的全部患者入组,进入最后临床评估阶段。据悉,天境生物正在美国开展TJ210/MOR210治疗肿瘤的I期临床研究。目前,菲泽妥单抗在中国已进入商业化的冲刺阶段。
“国内第二款上市的CD38单抗”称号花落谁家?
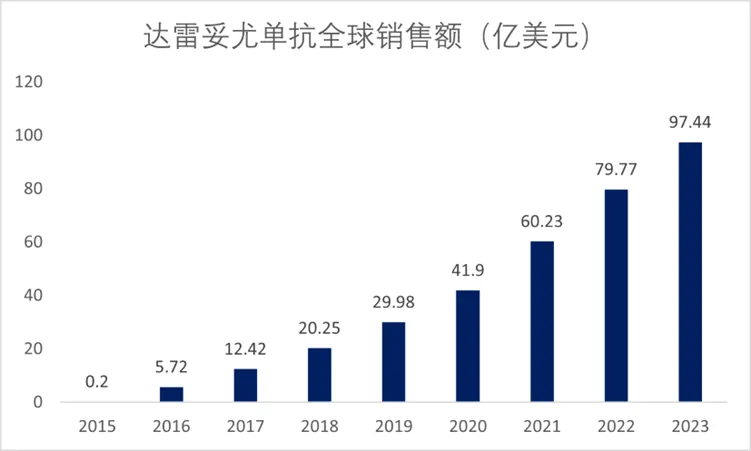
在CD38单抗领域,目前国内获批的CD38单抗仅有一款药物,为强生旗下在2019年获批上市的达雷妥尤单抗,主要适应症也是针对MM。达雷妥尤单抗自2015年上市后销售额稳步上升,2023年销售额达到97.44亿美元,2024年有望突破百亿美元大关,成为强生下一款百亿美元产品。
去年12月(CDE)官网公示,赛诺菲(Sanofi)申报了艾沙妥昔单抗注射液的上市申请,并获得受理。Sarclisa于2020年先后在美国、欧盟和日本获批上市,本次提交国内的上市申请为首次提交,顺利的话预计2024年下半年获批。
目前尚健生物的CD38单抗于上个月启动III期临床试验,成为首款进入III期阶段的国产CD38靶向药物。
谁能荣获“国内第二个上市的CD38单抗”称号?让我们拭目以待。
来源文章:公众号药研网,欢迎专注医药行业资讯分享,市场洞察及靶点介绍

本文作者可以追加内容哦 !

