GLP-1的下一站——增肌减脂
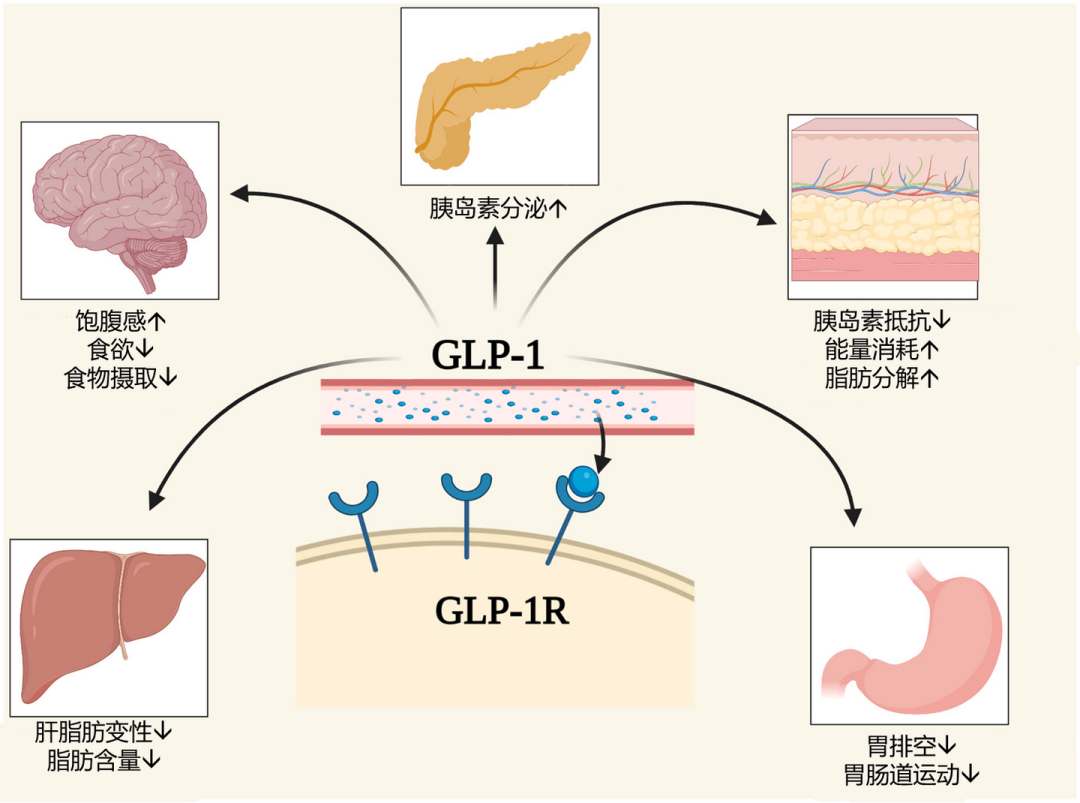
GLP-1的多靶点作用
GLP-1(胰高血糖素样肽-1)是一种由肠道细胞L分泌的激素,参与调节血糖水平,通过促进胰岛细胞释放胰岛素、抑制胰高血糖素分泌以及减缓胃排空和增加饱腹感来有效降低血糖,同时对体重管理和心血管健康都有着积极获益。
GLP-1是目前全球最热的药物研发靶点之一,得益于巨大的代谢和减肥市场需求。GLP-1RA(GLP-1受体激动剂)是一类药物,它们模拟GLP-1的作用,通过与GLP-1受体结合,增强GLP-1的生理效应。目前全球有13款GLP-1 RA上市,总体销售规模突破370亿美元。其中司美格鲁肽(Ozempic)以138.89亿美元销售额位列2023年全球畅销药TOP3,且3年来销售额翻了近4倍。目前全球涉及研发GLP-1研发管线数百条,包括多靶点联合、口服多肽与小分子、单克隆抗体、基因疗法,呈现拥挤状态。
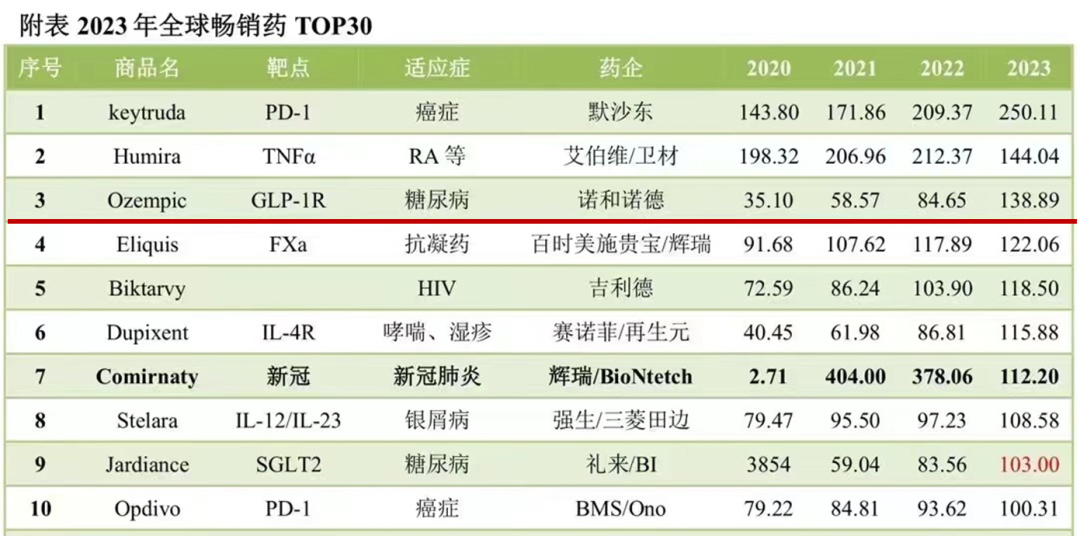
司美格鲁肽(Ozempic)位列2023年全球畅销药TOP3
尽管当前研发活动异常活跃且受到高度关注,但与此同时,GLP-1 RA也不可避免地伴随着种种质疑与争议。安全性聚焦于体重反弹、消化道症状、甲状腺癌症、抑郁自杀风险、肌肉减少等等。当然,FDA和EMA也做了一些调查,已发布声明表示无确切的证据证明GLP-1RA与甲状腺癌、自杀风险相关[1][2][3]。那么下面的事情,就聚焦在体重反弹和肌肉减少上。近期,诺和诺德披露研发战略,肥胖症领域将聚焦5个研发方向[4]:通过联合作用机制的探索,寻求更优疗效;减少给药频率;聚焦身体成分,维持肌肉含量;应对肥胖症这一慢性疾病,助力长期体重管理;治疗方案兼具安全性与耐受性。那么本文就聚焦在减肥的下一站——肌少症这一领域。
-01-
什么是肌少症?
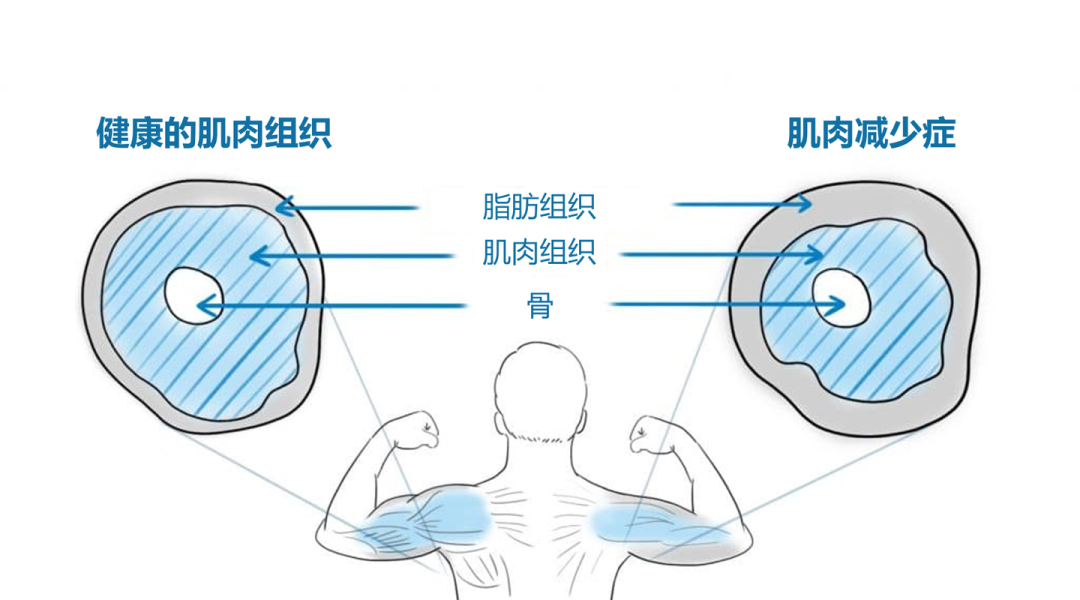
肌少症本是一种老年疾病,指的是进行性、广泛性的骨骼肌量减少,伴随肌力下降和人体功能下降的一类老年综合征[5],故其主要特征就是肌肉质量和肌肉力量的下降。肌肉质量的损失与衰老密切相关,通常开始于中年,并在晚年加速。在50 岁以上的正常成年人中,肌肉力量每10 年下降12%~14%;60~70 岁之间的老年人中有5%~13%患有肌肉减少症;而在80 岁以上的人群中,肌肉减少症的患病率高达11% ~50%[6]。
肌肉在维持生命活动中有着重要的作用,主要体现在以下3个方面:
故肌肉在维持生命正常活动中扮演着多方面的关键角色,从某种意义上来说,“Muscle”意味着强壮、年轻;而“Sarcopenia”(肌少症)意味着弱小、衰老,轻则疲劳乏力,重则是一种增加跌倒、骨折、身体残疾、代谢疾病、死亡等不良预后风险的进行性、全身性骨骼肌疾病[6][7]。
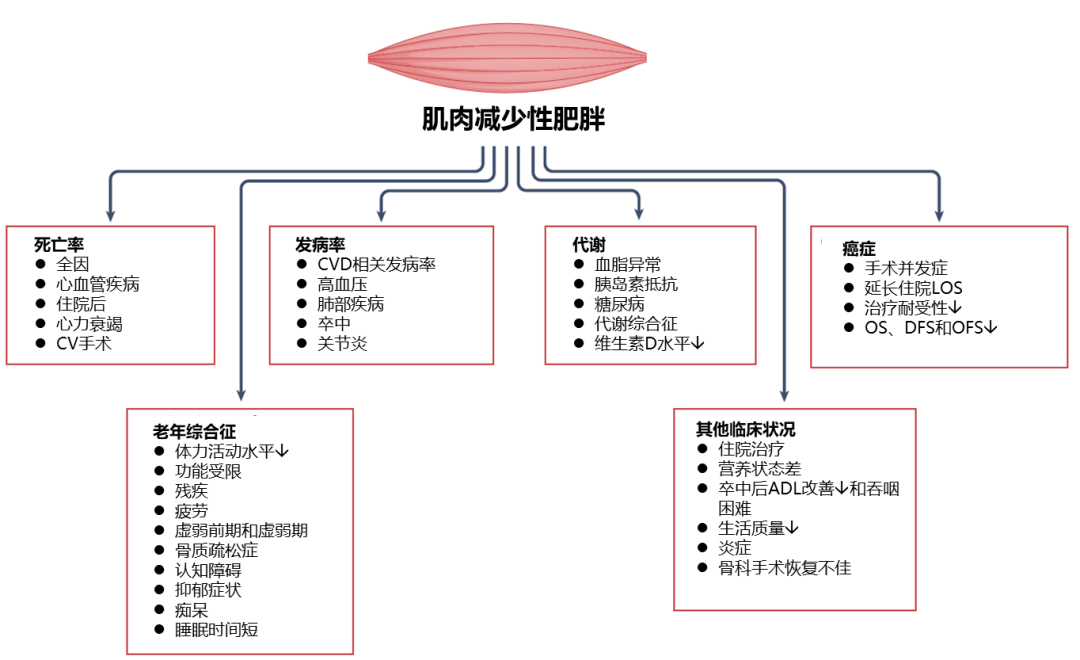
肌肉减少性肥胖的临床后果
-02-
GLP-1 RA与肌少症的关系

GLP-1 RA的减重效果
众所周知,GLP-1 RA能带来巨大的减重获益,临床试验显示其减重效果较基线可减少7.5%~24.2%。但在临床实践中发现,GLP-1 RA不仅减少了脂肪,也减少了肌肉含量。在司美格鲁肽68周的临床试验中[8],平均8.36kg的脂肪体重下降,也伴随着5.26kg瘦体重的下降。替尔泊肽中也观察到类似的结果,33.9%脂肪体重的下降伴着着10.9%的瘦体重下降[9]。可以推测出,使用GLP-1 RA减重的同时,会伴随25%~40%的肌肉流失。
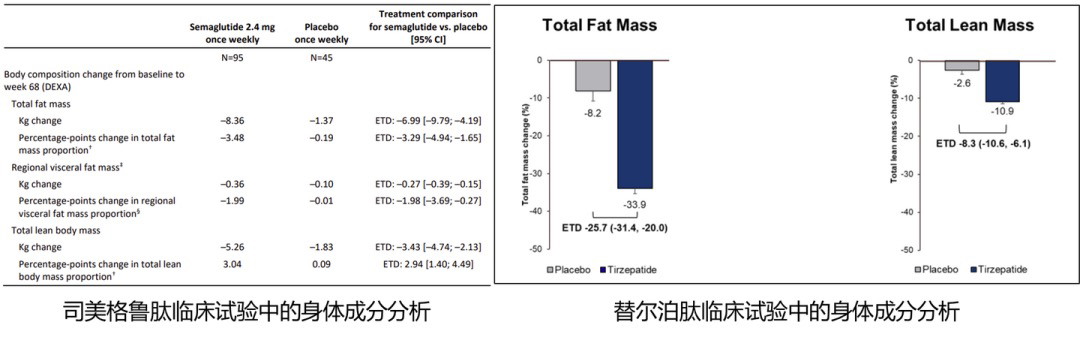
从客观的角度来看,在大多数减肥情况下,一定程度的瘦体重质量减少是必然的,若脂肪体重下降程度远大于瘦体重,也进一步说明尚存瘦体重的相对比重在增加。但随着体重下降程度越多,肌肉质量的绝对值损失的也就越多;而且50岁以上中老年人本身也存在着与年龄相关的肌肉减少事实,使用GLP-1RA势必进一步增加肌肉减少的风险。
因此在开发下一代减肥疗法时,给予了更高的要求,不仅仅追求体重数字的下降,而是更注重在减少脂肪的同时保持肌肉量,确保运动机能不受影响,并维持一个稳定的基础代谢率,也进一步降低因肌肉减少带来的风险问题。
-03-
GLP-1 RA与肌少症靶点联合
头部GLP-1公司都开展了GLP-1与肌少症靶点的药物联合开发,通过增肌减脂也在传递一种信息,GLP-1可以在糖心肾上获益,也可以在抗衰市场上进一步扩展。
目前积极活跃与GLP-1 RA进行联合开发的肌少症靶点主要包括以下几个方面:
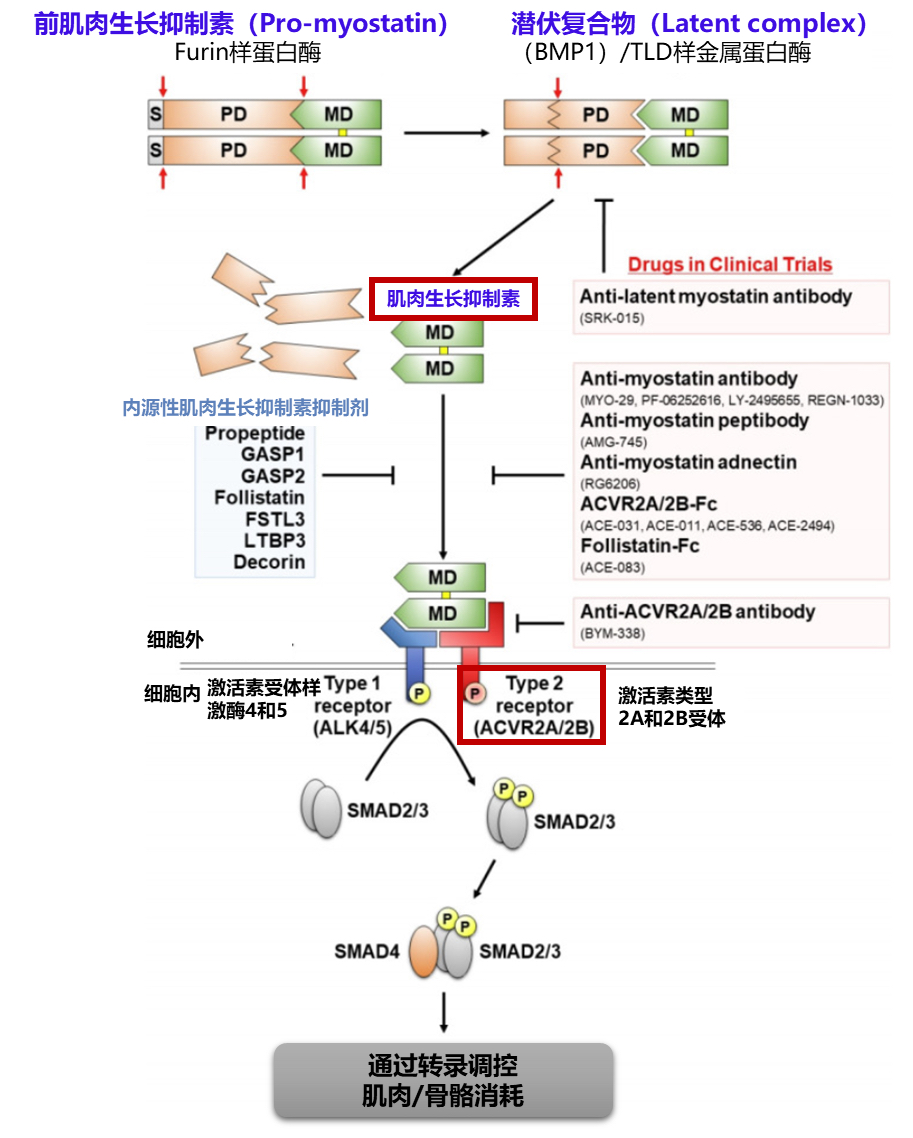
肌肉生长抑制素的作用机制
肌肉生长抑制素(Myostatin)是一种蛋白质,主要功能是限制肌肉的生长和发育,防止肌肉过度生长。在肌肉萎缩性疾病和肌少症中,肌肉生长抑制素存在过度表达的情况。如上图所示[10],肌肉生长抑制素起初以一种未激活的前体形式(Pro-myostatin)存在,经历多重蛋白酶切割,最终形成能够进行信号传导的成熟二聚体结构。成熟的肌肉生长抑制素通过与特定的细胞表面受体(ActRIIA/IIB和ALK4/5)结合,引发一系列级联反应,从而调节肌肉和骨骼的消耗。
而对抗肌肉生长抑制素“负负得正”可以获得肌肉生长的效果,主要的药物包括抗激活素类型II受体(ActRII)抗体和抗肌肉生长抑制素抗体。
研究显示,抗ActRII抗体不仅可以增加了瘦体重,而且显著降低了全身脂肪量并改善了胰岛素敏感性,代表药物为Bimagrumab。Bimagrumab由VersanisBio开发,23年公司被礼来以高达19亿美元收购。Bimagrumab单用(4周1次,静脉注射,连续48周)II期临床疗效显示[11],体重整体较基线减少5.9kg,但是由脂肪量减少7.49kg和瘦体重增加1.7kg组成,真正做到了减脂增肌。常见的不良事件主要包括轻度腹泻与肌肉痉挛。目前Bimagrumab正在和司美格鲁肽进行联合用药开发,探索是否能在体重减少的情况下保持或增加肌肉质量(NCT05616013)[12]。
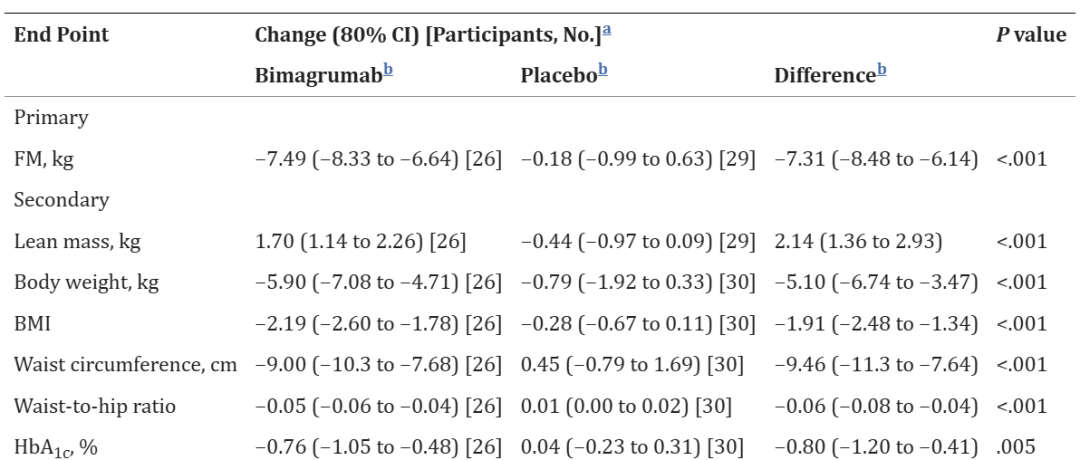
Bimagrumab单用II期临床主要终点
除此之外,再生元也将其开发的Trevogrumab(抗肌肉生长抑制素抗体)和Garetosmab(抗ActRII抗体)分别于司美格鲁肽进行联合用药(NCT06299098)[13],探索这两种组合增肌减脂的效果。近期,阿斯利康也与SixPeaks Bio进行战略合作,旨在其拥有一款“best in class”的抗ActRII抗体,但具体临床数据不详。
酮可以通过刺激成肌细胞和抑制肌肉生长抑素参与肌细胞的修复。随着年龄的增长,酮水平会降低,导致肌肉蛋白质合成减少和肌肉分解增加[14]。
Enobosarm是一种需每日口服的选择性雄激素受体调节剂(SARM),由Veru公司开发,在前期健康老年人的II期研究中,已显示具有组织选择性和剂量依赖性的改善身体组成的能力,可以增加肌肉质量并减少脂肪量,3mg可增加1.2kg瘦体重,减少0.3kg脂肪体重,整体增加0.9kg体重,因此增加肌肉力量和改善身体功能[15],且对女性无男性化效应。
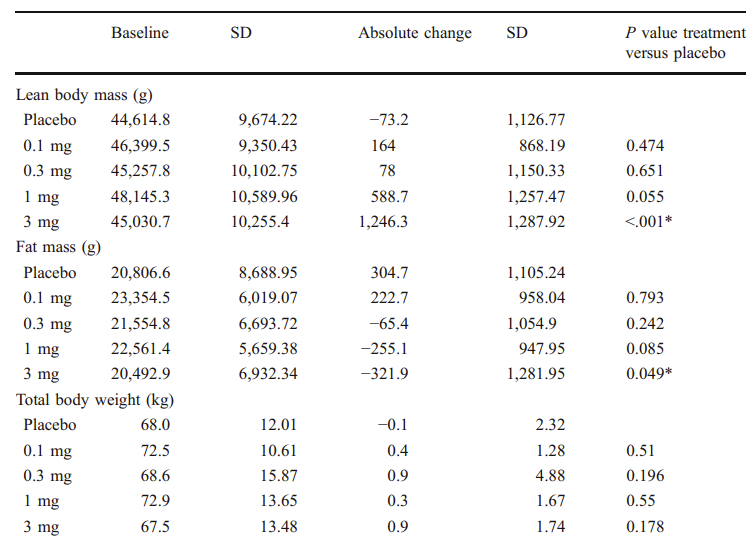
Enobosarm在II期健康老年人中的临床研究
目前Enobosarm开展了IIa临床试验(NCT06282458)[16],前4个月与司美格鲁肽进行联合用药以探索是否具有减重且保持肌肉质量的功效,后3个月单用Enobosarm以观察肌肉量的维持效果以及脂肪的反弹情况。
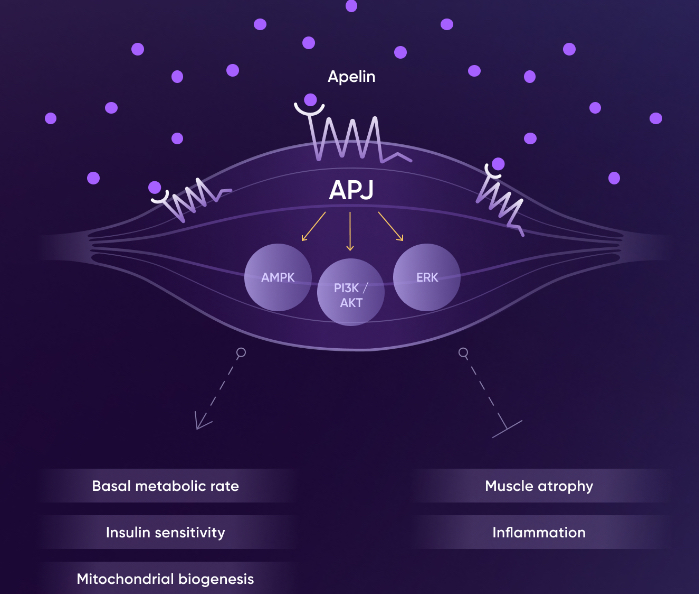
Apelin受体激动剂的作用机制
Apelin受体激动剂能够与APJ受体高亲和力结合,在多种生理过程中发挥关键作用,包括心血管调控、能量代谢、水盐平衡以及免疫反应等。受体激活后,进一步激活或抑制下游的信号传导通路,比如磷脂酰肌醇-3-激酶(PI3K)/Akt途径、腺苷酸激活蛋白激酶(AMPK)途径和细胞外信号调节激酶(ERK)途径。在减肥疗法的背景下,Apelin受体激动剂可能通过促进脂肪分解、抑制脂肪生成、增加能量消耗或改善胰岛素敏感性来帮助减脂,同时努力保持或增加肌肉量。
Azelaprag(BGE-105)是一种高选择性、强效、每日口服的Apelin受体激动剂,由BioAge公司开发,前期致力于开发老年人预防肌肉萎缩适应症,在Ib试验中探索到了初步疗效[17]。与GLP-1 RA的联合使用在临床前动物试验中显示可降低体重,优化身体成分与身体功能的疗效。目前正与小剂量的替尔泊肽联合用药进行II期临床试验,受试者招募将从55岁及以上的人群开始,验证其增肌减脂的功效。
-04-
总结
现阶段是一个代谢病市场,而未来是老年疾病市场,老年人通常伴随着多种疾病,包括与糖、心、肾、脑有关的慢性代谢疾病,也包括与骨、肌有关的退行性疾病。GLP-1 RA与肌少症靶点的联合开发,既可以在减肥的同时保证身体成分的优化,减脂增肌;也可将代谢疾病与退行性疾病联合起来,为老年人的晚年高质量生活提供更多的治疗可能性。
目前研发进度最快的是抗ActRII抗体Bimagrumab,II期临床近期可完成研究,下一步将会开展更大样本量的III期临床进一步验证安全性和有效性。联合用药需要考虑多种因素,例如药物的相互作用,药物的剂量调整,考察不良反应的叠加性,长期使用的安全性,尤其是两种药物均为生物药,需要重点关注免疫原性与抗药性。
选择性雄激素受体调节剂和艾帕素受体激动剂目前均为小分子化药,需每日口服,从用药频率来看,与周制剂的GLP-1 RA似乎有些不搭,但是考虑GLP-1 RA也在研发小分子化药,这种小分子与小分子的复方或许是一种更好的组合。当然依旧要面临着药物相互作用、剂量选择、安全性等多种问题。
综上所述,GLP-1 RA作为一类有效的糖尿病与肥胖治疗药物,不仅通过调节血糖、促进体重减轻展现了其显著的治疗价值,与肌少症靶点药物的联合使用揭示了其精准减肥的潜力,这种协同效应,不仅能有效控制血糖和体重,还能积极干预肌肉减少和功能衰退。未来,通过跨学科的研究,能够实现多种靶点的有效联合,精准预测治疗反应,最终实现多种疾病的预防和治疗,提升整体人群的生活质量和健康预期。
本文作者可以追加内容哦 !

