2024年8月1日,宜明昂科-B(01541)发布公告称,与Instil Bio, Inc (NASDAQ: TIL)全资子公司SynBioTx Inc.达成独家对外授权协议:宜明昂科将其两款在研创新管线产品IMM2510(VEGFxPD-L1 mAb-Trap)和IMM27M(CTLA-4, ADCC加强型)大中华区以外的开发及商业化权利授权SynBioTx Inc.,同时保留两款产品在大中华区的权利。宜明昂科将获得5000万美金的首付款及近期付款,以及超过20亿美金的后续开发、注册、商业化里程碑付款,及单位数至低双位数的大中华区以外的销售提成。
IMM2510由宜明昂科自主研发,是一款靶向VEGF及PD-L1的双特异性分子,采用单克隆抗体-受体重组蛋白(mAb-Trap)结构。IMM2510能够通过阻断VEGF/VEGFR信号通路,抑制肿瘤血管生成从而抑制肿瘤的生长和转移,并使肿瘤细胞对免疫反应更敏感,同时通过阻断PD-L1/PD-1相互作用及诱导Fc介导的抗体依赖的细胞毒性作用(ADCC)和抗体依赖的细胞吞噬作用(ADCP)活性激活T细胞、自然杀伤细胞及巨噬细胞,从而发挥抗肿瘤免疫治疗作用。
同时靶向 PD-(L)1 和 VEGF的双特异性分子在治疗恶性实体瘤方面有着巨大的市场前景。今年5月,康方生物披露了依沃西单抗(PD-1/VEGF双特异性抗体)单药头对头K药一线治疗PD-L1阳性的NSCLC III期临床数据取得阳性结果,点燃了业界对于其未来在该适应症上替代K药等PD-1单抗的期待。普米斯生物的PM8002(PD-L1/VEGF双特异性抗体)也在三阴性乳腺癌中取得亮眼的临床数据。而在2022和2023年,康方和普米斯分别与Summit Therapeutics和BioNTech达成了金额可观的授权合作。
作为国内临床开发进度处于第一梯队的VEGF/PD-L1双特异性分子,宜明昂科的IMM2510多个项目已经进入临床phase Ib/II 阶段,包括单药和联合治疗项目。2024 ASCO年会上公布的I期剂量递增结果显示,IMM2510总体耐受性良好并在实体瘤中展示出积极的疗效信号:在不同剂量下,2例既往免疫治疗失败的非小细胞肺鳞癌患者及1例胸腺鳞癌患者取得了部分缓解(PR),在7例疾病稳定(SD)的实体瘤患者中, 4例取得肿瘤缩小15%以上的SD(其中两例为非小细胞肺癌)。
此次交易中的另一个产品IMM27M是新一代CTLA-4抗体,具有增强的ADCC活性。其可诱导靶向CTLA-4过度表达、具有免疫抑制作用的调节性T细胞的强效免疫反应,促进调节性T细胞从肿瘤微环境(TME)中清除,从而增强T细胞的抗肿瘤反应。
IMM27M已完成I期剂量递增的患者招募工作, 2023年ASCO年会上公布的数据显示IMM27M总体耐受性良好:在较广的剂量范围里,所有受试者均没有出现剂量限制性毒性(DLT)。在两例经过多线治疗后的激素受体阳性(HR+)的晚期乳腺癌患者中观察到积极的疗效(两例均获得PR);一例晚期复发的实体瘤患者中观察到肿瘤缩小超过20%的SD。乳腺癌是女性发病率最高的恶性肿瘤,根据WHO数据,2022年全球有230万女性被诊断患乳腺癌,激素受体阳性乳腺癌占总体乳腺癌的约70%。
IMM2510和IMM27M在肺癌、乳腺癌及其他实体瘤方面积极的疗效表现,为这两个产品在市场潜力巨大的实体瘤领域的后续开发打下了良好的开端。加上合作方和美国资本市场的加持,有望未来快速推进国际临床进展。
01 差异化优势的CD47
宜明昂科从成立伊始,就一直被标签为CD47靶点研发的biotech。其核心产品替达派西普 (IMM01) 已有三个适应症获批III期注册临床,其中IMM01联合替雷利珠单抗针对PD-(L)1单抗难治性经典霍奇金淋巴瘤(cHL)Ⅲ期注册临床试验于7月初完成首例患者入组给药。
作为一个关键的巨噬细胞检查点,在多种肿瘤细胞表面都有表达,CD47曾被认为是继PD-1/PD-L1之后潜力巨大的肿瘤免疫靶点。然而在过去两年里,相关药物的研发屡屡碰壁。
面对市场的担忧和疑虑,宜明昂科创始人田文志博士曾对IMM01的差异化优势进行了介绍:“IMM01是SIRP-Fc融合蛋白。为解决CD47分子的安全性问题,IMM01与CD47结合区域采用了一个工程化的人类SIRP结构域,在体外研究中,该结构域显示不与人体红细胞结合,具有很强的安全性优势。另外,公司还对该结构域采取了去糖基化的修饰,降低了分子的免疫原性。IMM01通过双重作用机制充分激活巨噬细胞,即干扰CD47/SIRP相互作用阻断“别吃我”信号,并通过激活巨噬细胞的Fc受体传递“吃我”信号。横向对比看,IMM01的亲和力KD为~3nM,约为Magrolimab的千分之一,适中的亲和力使得IMM01的外周血受体占位维持在10-15%的水平,(而Magrolimab用药后14天为90%以上),从而避免了CD47抗体药物常见的抗原沉默效应。IMM001的Ⅱ期推荐剂量仅为2.0mg/kg,CD47抗体剂量通常在20至45mg/kg之间。”
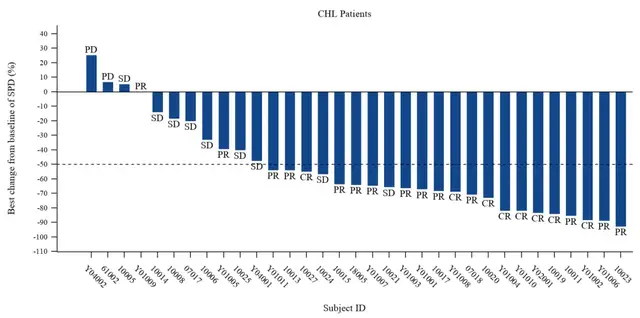
替达派西普的优势也在临床数据中得到了印证,两项II期临床研究数据—IMM01联合阿扎胞苷(AZA)治疗初治较高风险的骨髓增生异常综合征(HR-MDS)和IMM01联合替雷利珠单抗治疗既往PD-1抗体治疗失败后的经典霍奇金淋巴瘤(cHL)入选2024 ASCO口头报告,以其优秀的疗效和安全性数据赢得了现场的热烈反响。其中IMM01联合替雷利珠单抗治疗既往PD-1抗体治疗失败后cHL的口头报告被2024年中国临床肿瘤学年度进展研讨会(BOC)评选为Best of ASCO in China 。
根据ASCO数据,IMM01联合阿扎胞苷治疗初治HR-MDS适应症方面,在整体51个可评估患者中,完全缓解率(CR)达到33.3%,总体反应率达到64.7%;在治疗超过4个月的34名患者中,CR达到50.0%, ORR达到85.3%;而在治疗超过6个月的29名患者中,CR达到58.6%, ORR达到89.7%;反应随着治疗时间的延长,疗效持续提升。中位观察时间为15.9个月,中位无进展生存期(mPFS)和中位总生存期(mOS)未达到,12个月OS为71.1%。同时还观察到IMM01+AZA联合治疗后整体血红蛋白(HGB)和血小板(PLT)明显恢复,血红蛋白或血小板输注显著减少。IMM01联合AZA做为一线治疗成人较高风险MDS患者耐受性良好,疗效显著。
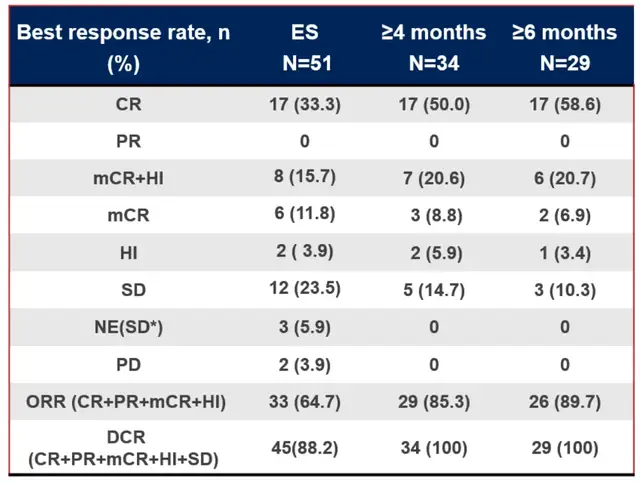
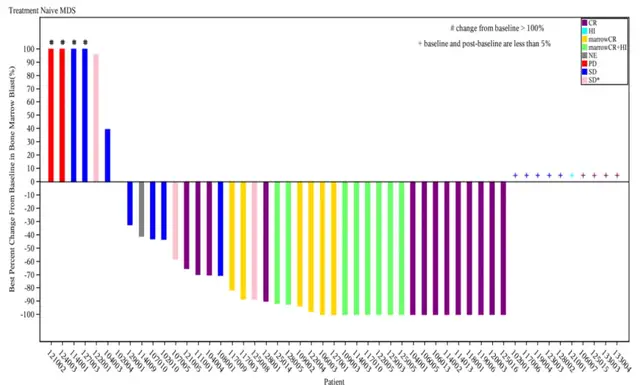
(骨髓原始细胞较基线的最佳百分比变化)
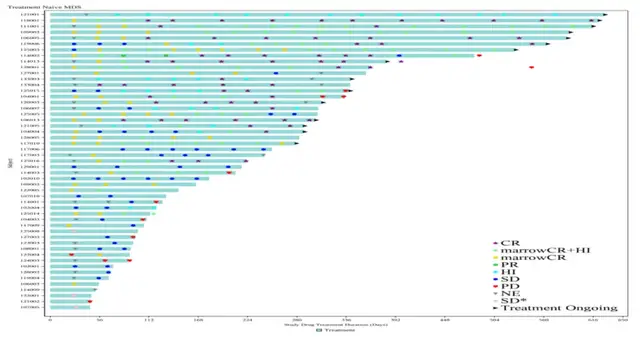
(治疗持续时间及反应)
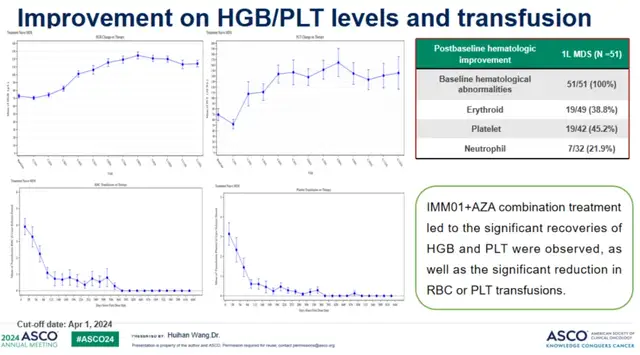
(在51例可评估患者中经过治疗后血红蛋白和血小板明显恢复,血红蛋白或血小板输注显著减少)
IMM01联合替雷利珠单抗治疗既往PD-1抗体治疗失败后的cHL II期试验数据显示,在33例可评估患者中(此前接受的平均治疗线数为4线),ORR达到66.7%, CR 率达到 24.2%。在29例(87.9%)患者中观察到靶病灶大小的减小。中位观察时间为6.87个月,中位至缓解时间为1.6个月,中位无进展生存期和中位持续缓解时间未达到。总体安全性耐受性良好,未观察到溶血的发生。
02 不只是CD47
作为一家全自研的创新药研发平台型公司,纵观宜明昂科产品线,除了CD47和本次对外授权的VEGF x PD-L1和CTLA-4 ADCC+, 亦有布局靶向CD24, CD70等创新分子,以及代谢领域大有可为的ActRIIA和此靶点相关的双抗。而在竞争格局相对良好且市场空间巨大的自免领域,宜明昂科的Amulirafusp alfa (IMM0306, CD47x CD20 mAb-Trap)已获得两个适应症IND批件。
宜明昂科此次授权合作方Instil Bio为一家专注创新肿瘤治疗的临床阶段biotech公司。根据该公司官网资料,其CEO Bronson Crouch是一位生物医药行业资深创业者和投资人,他曾投资的Peloton Therapeutics于2019年被Merk以11亿美金首付款收购,核心产品Belzutifan(PT2977)于2023年获FDA批准上市,治疗晚期肾细胞癌;另一家肿瘤免疫公司CoStim Pharmaceuticals, Inc.于2014年被诺华收购,成交金额未披露。
此次BD合作,除了给宜明昂科带来可观的现金流外,也将助力宜明昂科在市场空间更大的实体瘤板块加速推进。$宜明昂科-B(HK|01541)$$康方生物(HK|09926)$$康宁杰瑞制药-B(HK|09966)$
本文作者可以追加内容哦 !

