
8月14日,据CDE官网显示,$百济神州(HK|06160)$(苏州)生物科技有限公司(以下简称“百济神州”)的1类新药BGB-45035片获得临床试验默示许可,适应症为中重度特应性皮炎。据公开资料显示,该药物为一款IRAK4 PROTAC。是百济神州在自有CDAC平台上研发的第二款靶向降解剂。此次获批临床,是百济神州免疫和炎症治疗领域的一项新进展。
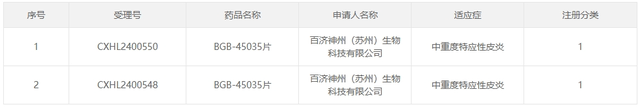
据药融云数据库显示,BGB-45035作为一款创新的IRAK4 PROTAC(蛋白水解靶向嵌合体)药物,是百济神州依托其先进的CDAC(细胞降解靶向复合物)平台精心研发的第二款靶向降解剂。该药物展现出强大的潜力,能够诱导IRAK4蛋白实现更深层次的降解,同时展现出更快的降解速度及增强的细胞因子抑制作用,为治疗包括特应性皮炎在内的多种自身免疫性疾病提供了新的希望。
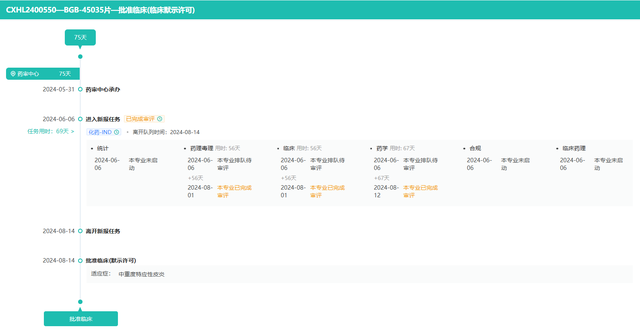
值得注意的是,为全面评估BGB-45035的安全性与有效性,百济神州已于今年6月启动了一项精心设计的1期随机临床试验。该试验旨在探索BGB-45035在健康受试者中,单次及多次递增剂量下的安全性、耐受性、药代动力学特性、药效学表现以及食物对其可能产生的影响,预计招募受试者总数将达到92人。
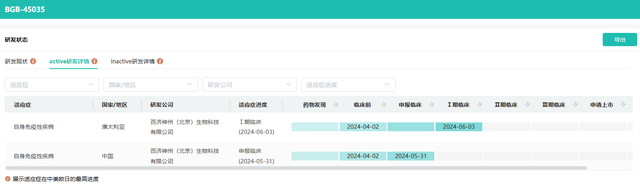
本次BGB-45035获得临床试验默示许可后,百济神州或将在国内开启对其的进一步研究,为饱受中重度特应性皮炎困扰的患者带来福音。
参考来源:
[1] CDE官网
[2] 药融云数据库
<END>
追加内容
本文作者可以追加内容哦 !

