海创药业自主研发的1类新药氘恩扎鲁胺软胶囊(以下简称“HC-1119”)是恩扎卢胺的氘代化合物,已获得国家重大新药创制科技重大专项支持,获批后有成为Best-in-class(同类最佳)品种的潜力。
临床结果显示,与恩杂鲁胺相比,德恩鲁胺有效性更高,80mg德恩鲁胺与160mg恩杂鲁胺疗效相当;临床拟用剂量减少一半,病人依从性更好;临床受试者中未有癫痫发生,安全性更好;且德恩鲁胺化合物专利将于 2032 年到期,专利有效期更长。
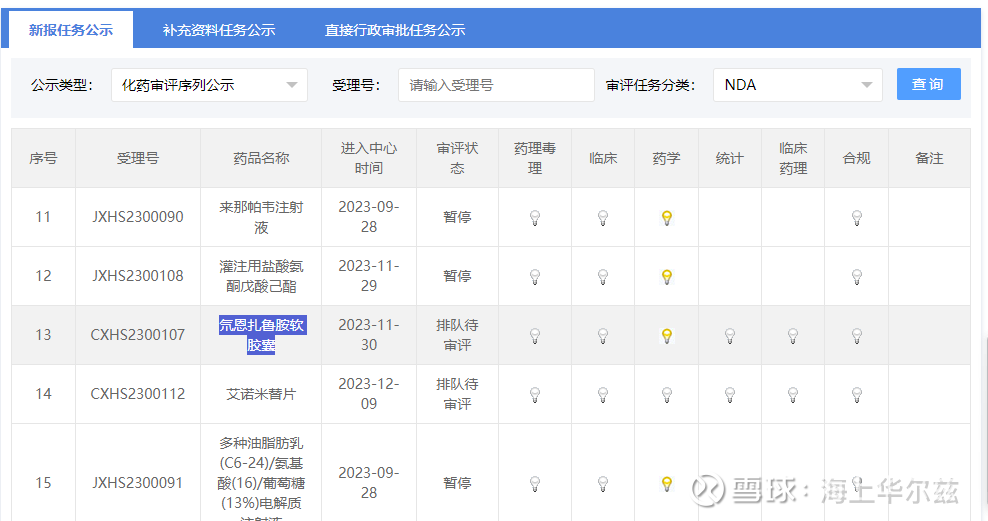
海创药业公告称:HC-1119新药上市申请于 2023 年 11 月获 NMPA 受理,目前CDE已完成对HC-1119药理毒理、临床、统计、临床药理及合规部门的审评工作,CDE灭灯移除网站过程中,预计有望在2024H2获批上市。
如果 HC-1119 获得批准,将是首款获批上市治疗阿比特龙/化疗后的转移性去势抵抗性前列腺癌的国产创新癌症药物,有望填补这个治疗领域的空缺市场,解决患者未满足的临床需求。
德恩鲁胺胶囊采用双盲,对比组为安慰剂,直接头对头恩杂鲁胺。以下是前一代前列腺癌恩杂鲁胺的市场情况,从中可以揣摩出海创药业另辟蹊径,满足临床需求的策略是很超前的。
氘恩扎鲁胺原料药是委托天津凯莱英进行生产的,23.11月已经提交了上市申请并通过NMPA注册。制剂氘恩扎鲁胺软胶囊是委托武汉人福普克药业进行代工,也是23年11月提交了上市申请,剂型靶点是Androgen Receptor(AR);D-Box Binding PAR BZIP Transcription Factor(DBP);Triiodothyronine Receptor Auxiliary Protein(TRAP),一般通道评审。
恩杂鲁胺(Enzalutamide)是一种用于治疗前列腺癌的创新药物,由安斯泰来(Astellas Pharma)和Medivation共同研发。属于雄激素受体抑制剂,用于治疗前列腺癌。
1. 专利到期时间:恩杂鲁胺的核心化合物专利CN101222922B预计将于2026年3月29日到期,晶型专利延长到2032年。
2. 原研公司:恩杂鲁胺的原研公司是安斯泰来(Astellas Pharma)和Medivation。Medivation后被辉瑞(Pfizer)收购 。
3. 全球销售额:2022年恩杂鲁胺在日本的销售额约为48.97亿美元,西南证券预测2024年该市场规模预计达到133亿美元,2030 年达到 212亿美元。
4. 中国上市时间:恩杂鲁胺于2019年11月18日在中国获得批准上市 ,专利到2032年到期,国内恩杂鲁胺片仿制药在此之前均无法上市销售。
5. 中国销售额:目前没有公开的确切数字显示恩杂鲁胺在中国的销售额。 但根据东方财富证券研究所的报告,中国前列腺癌药物市场规模预计将在2024年达到约155亿元人民币,2030年预计将达到506亿元人民币。表明包括恩杂鲁胺在内的前列腺癌药物市场空间巨大。
6. 同类药物:目前全球范围内已有7款AR拮抗剂获批上市,国内已有5款,最老的当属阿斯利康的比卡鲁胺,其次是辉瑞/安斯泰来的恩扎卢胺、强生的阿帕他胺、拜耳的达罗他胺以及恒瑞的瑞维鲁胺。恒瑞医药的瑞维鲁胺是中国首个自主研发的新型AR抑制剂,于2022年6月获得CDE批准上市,用于治疗高瘤负荷的转移性激素敏感性前列腺癌(mHSPC),同时纳入医保支付。
海创药业上市之后迎来了创新药的爆发期,其中2023年就有10个创新药进入临床,其中个创新药已经提交CDE上市申请。进入到2024年又有4个1类创新药进入临床,同时海外美国FDA进行双申报,另有若干具有BIC前景的产品进入快速审批通道。
创新药方面:2023年申报的1类创新药HP568片临床申请获得CDE受理,该药物是高效且口服可用的靶向雌激素受体(ER)的PROTAC降解剂,适应症为于乳腺癌治疗。2024年7月月3日海创药业公告称,其在研药物HP518片获得美国食品药品监督管理局(FDA)的“快速通道认定FTD认证”,有望加速获批上市。HP518片是海创药业自主研发的蛋白降解靶向联合体 (PROTAC)药物,拟用于晚期前列腺癌(mCRPC)及雄激素受体(AR)阳性三阴乳腺癌,目前国内外均无同类靶点产品获批上市。HP518片已在澳大利亚完成用于治疗转移性去势抵抗性前列腺癌(mCRPC)的I期临床试验,在患者中显示出积极的疗效。其用于治疗m CRPC的临床试验申请已于2023年1月获FDA批准,中国I/II期临床试验申请于2023年11月获NMPA批准,并于2023年12月完成首例受试者给药,目前正在入组中。
作为十年磨一剑的“重磅开篇之作”,德恩鲁胺软胶囊就瞄准了临床痛点,对症下药。随着CDE审评的加速,有望在四季度获批上市,当下美联储降息预期,公司的相关靶点有望加速流入市场,公司估值也有望重回巅峰。
【上市时间专业预测:目前CDE灯6灭5,仅有药学一项,从8月5日开始亮灯,预计35日内灭灯(9月10日)。】
1. 不用补充资料,很快出三合一报告,制证,预计9月27日获批上市。
2. 如果CDE发补资料通知,计时暂停,提交补充材料后再次恢复技术审评,再次亮灯,时间增加三分之一80日。然后三合一报告,提交药监局签字批准。预计最快12月获批。
参考兴齐眼药阿托品滴眼液:23年9月14日,CDE 6灯全灭,之后发补,重新亮灯;到24年2月23日,6灯再次全灭。最终是24年3月11日获批上市。
本文作者可以追加内容哦 !

