近期,国产自免药物正上演着一场精彩的“速度与激情”。
先是恒瑞医药、智翔金泰两款国产IL-17A单抗率先冲线、获得上市批准,接着恒瑞的JAK1抑制剂艾玛昔替尼在国内提交新适应症(用于治疗斑秃)的上市申请,康诺亚的司普奇拜单抗也在本月获批上市,成为国内首个IL-4R靶点药物,可见国产自免药物迎来了密集收获期。
更引人注目的是,还有不少国内药企在积极布局自免领域潜力新靶点。这让人不禁遐想,国产自免药物的未来究竟还有多少令人期待的惊喜?
01
迎密集收获期,
国产自免药物新纪元
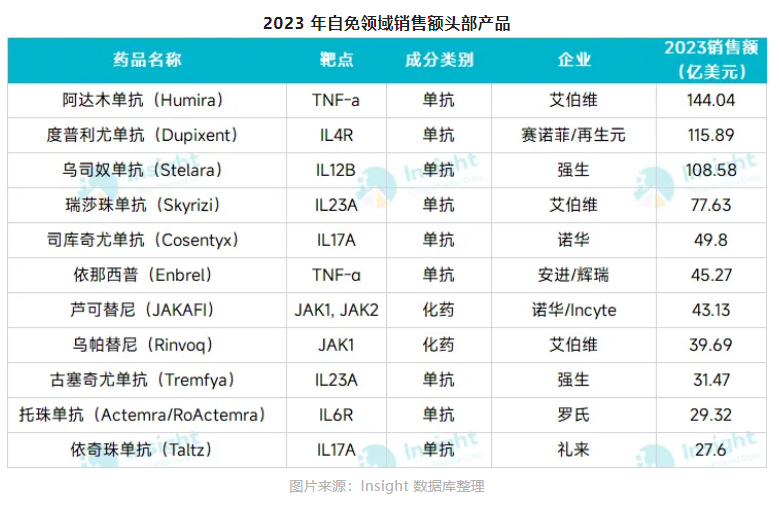
此前,自免领域的主流药物是以艾伯维的阿达木单抗等为代表的TNF-抑制剂。而今,白介素(IL)和JAK靶向药物成为了新一代的自免药物。
以白介素抑制剂为例,目前全球已获批上市的靶点类型,包括IL-4R、IL-17A、IL-12/IL-23等,而且各个细分赛道都诞生了年销售额超10亿美元的“重磅炸弹药物”,甚至是年销售额超百亿美元的“超级重磅炸弹”。
现如今,国内药企也在这一领域迎来了密集收获期。
IL-4R药物领域的头部产品是赛诺菲/再生元的度普利尤单抗,2023年销售额高达115.89亿美元,尤其2024年上半年销售额约66.6亿美元,超越阿达木单抗、强生的乌司奴单抗,成为新一代自免“药王”。
值得一提的是,国产首款IL-4R单抗已经诞生:康诺亚/石药集团的司普奇拜单抗(CM310)已在本月获批上市,成为国产首款IL-4R单抗。根据非头对头研究数据显示,司普奇拜单抗治疗特应性皮炎的疗效优于度普利尤单抗。
巨大的市场蛋糕,注定了这一领域竞争激烈。根据insight数据库,目前还有8款国产IL-4R单抗处于Ⅲ期临床,包括康方生物的曼多奇单抗、智翔金泰 GR1802、恒瑞医药 SHR-1819、三生国健 SSGJ-611、康乃德生物 CBP-201等。
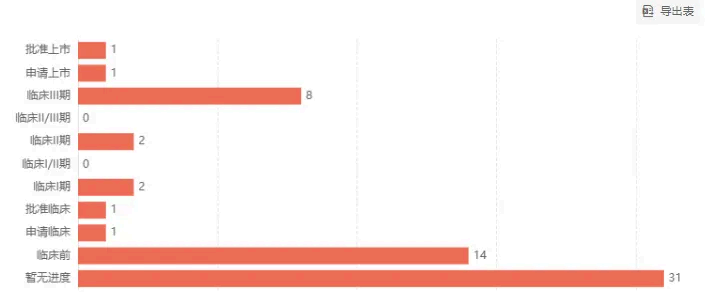
IL-4R 单抗国内研发进度
截图来自:Insight 数据库网页版
IL-17单抗领域的头部产品是诺华的司库奇尤单抗,2023年销售额达49.8亿美元。
不久前,两款国产IL-17A单抗相继获批上市,打破了既往外资药企垄断的局面,分别是恒瑞医药的夫那奇珠单抗、智翔金泰的赛力奇单抗,均用于治疗中重度斑块状银屑病。
此外,还有不少国产IL-17A单抗进入Ⅲ期临床,包括康方生物 AK111(古莫奇单抗)、君实生物005、三生国健 SSGJ-608、荃信生物 QX002N、丽珠医药/鑫康合 XKH004。而且,百奥泰、石药集团和甘李药业还布局了司库奇尤单抗生物类似药,市场竞争激烈。
IL-12/IL-23靶点的竞争同样激烈,这一领域的头部产品是强生IL-12/23抑制剂乌司奴单抗,2023年销售额达108.58亿美元,以及艾伯维IL-23抑制剂瑞莎珠单抗,2023年销售额同比增长50.3%至77.63亿美元。
不过,由于专利到期的影响,2024年上半年乌司奴单抗的销售额仅同比微增1.8%至53.36亿美元。反过来,瑞莎珠单抗今年上半年销售额继续同比大增46%至47.35亿美元。
国内方面,也有不少药物临近商业化,其中康方生物IL-12/23单抗AK101(依若奇单抗)、艾伯维IL-23抑制剂利生奇珠单抗均已申报上市,信达生物IL-23p19抗体匹康奇拜单抗(IBI112)正在递交上市申请,礼来IL-23p19抑制剂mirikizumab正在开展Ⅲ期临床。
今年4月,翰森制药斥资超11亿元引进荃信生物IL-23p19抑制剂QX004N在大中华区的权益,目前该药正在开展针对银屑病的Ⅱ期临床和针对克罗恩病的Ⅰa期临床试验。
另外,乌司奴单抗生物类似药方面,百奥泰、华东医药/荃信生物均已申报上市,石药集团SYSA-1902也已处于Ⅲ期临床。
02
国产JAK抑制剂:
迪哲领跑,泽璟、恒瑞接力
除白介素抑制剂外,JAK抑制剂也是新一代的热门自免药物。
目前,全球已有近20款JAK抑制剂获批上市,其中头部产品包括诺华/Incyte的芦可替尼、艾伯维的乌帕替尼,2023年销售额分别达43亿美元、39.7亿美元。
2024年上半年,乌帕替尼销售额继续同比增长57.3%至25.23亿美元,仅次于诺华的IL-17单抗司库奇尤单抗(28.52亿美元),同期芦可替尼的销售额也达到24.34亿美元。
国内方面,JAK抑制剂市场竞争相当激烈。据Insight数据库显示,截止2024年9月12日,已有10款JAK抑制剂在中国获批上市,4款JAK抑制剂处于NDA阶段,另外还有53款JAK靶点的临床阶段药品,主要适应症集中于类风湿关节炎、特异性皮炎等自免疾病。
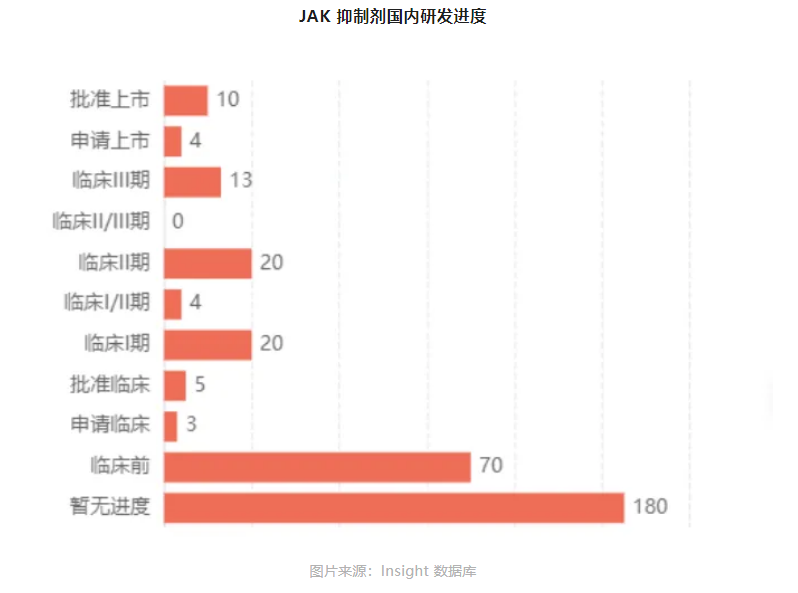
国产JAK抑制剂方面,迪哲医药的戈利昔替尼处于第一梯队(已获批上市),已于今年6月获批上市,单药适用于既往至少接受过一线系统性治疗的复发或难治的外周T细胞淋巴瘤(r/r PTCL)成人患者。但是其适应症布局主要集中在肿瘤领域,自免相关领域适应症尚未进入临床阶段。
PTCL在所有非霍奇金淋巴瘤中生存率最低,r/r PTCL患者的生存预后极差,针对这一群体的既往单药治疗效果极为有限,3年生存率仅为23%, 中位总生存期(OS)仅5.8个月,并且该领域近十年没有创新药上市。
由此,戈利昔替尼成为了全球首个且唯一作用于JAK/STAT通路的治疗r/r PTCL的新药物,突破了这一领域的临床治疗瓶颈。
进度处于第二梯队(已申报上市)的的国产JAK抑制剂,包括恒瑞医药的艾玛昔替尼(SHR0302)、泽璟制药的吉卡昔替尼(曾用名:杰克替尼)。
艾玛昔替尼是恒瑞自研的新一代高选择性JAK1抑制剂,对JAK1的选择性是对JAK2的16倍,目前已在国内递交了4项适应症的上市申请,包括用于强直性嵴柱炎、特应性皮炎、类风湿关节炎和斑秃,其中前3项适应症有望于2025年上半年获批上市,目前在自免领域是国产JAK抑制剂中进展最快的。
吉卡昔替尼是一种新型JAK和ACVR1双抑制剂类药物,对Janus激酶包括JAK1、JAK2、JAK3和TYK2具有显著的抑制作用,目前除已提交治疗中、高危骨髓纤维化的上市申请外,针对斑秃、特应性皮炎、强直性嵴柱炎、特发性肺纤维化、斑块状银屑病等适应症均已处于II期临床及以上阶段。
此外,国内其他在研的JAK抑制剂,还包括信达生物的伊他替尼(Itacitinib)、先声药业/凌科药业的LNK01001、科伦药业KL130008等。
03
潜力新靶点层出不穷
自免药物研发的故事还未结束。
从TNF-逐渐被白介素、JAK替代,自免药物靶点呈现出明显的代际更迭。如今,自免领域还在不断冒出潜力新靶点,吸引了跨国制药巨头和国内药企的目光。
这几年,MNC巨头频繁布局炎症性肠病(IBD)等存在巨大未满足需求的自免疾病。
IBD终生可复发,被称为“不死的癌症”,主要包括溃疡性结肠炎(UC)和克罗恩病(CD)两种类型,目前尚无根治IBD的方法,且患者人数庞大。据流行病学数据显示,目前全球约有600-800万IBD患者,主要集中在欧美地区。
目前,MNC巨头在IBD领域的布局方向主要集中在TL1A和整合素47。
例如,默沙东豪掷108亿美元收购Prometheus Biosciences,拿下了治疗UC的TL1A单抗PRA023;罗氏斥资72.5亿美元收购Telavant,获得了治疗IBD的潜在首创新型TL1A抗体RVT-3101。
尤其是47靶点已诞生了大药,武田制药的47整合素抑制剂Entyvio(维得利珠单抗)2023年销售额超过50亿美元,而且在针对UC的头对头试验中击败了阿达木单抗。
基于此,礼来进行了频繁布局,先是以24亿美元收购Dice Therapeutics,获得口服47项目和IL-17小分子抑制剂,后又斥资32亿美元收购Morphic Therapeutics,拿下口服47整合素小分子抑制剂MORF-057。
尽管当前国内药企鲜有布局IBD领域,但管线也深受MNC巨头青睐。今年6月,“自免一哥”艾伯维斥资超17亿美元引进了明济生物的临床前TL1A单抗FG-M701,其中首付款达1.5亿美元,足见这类药物的市场潜力。
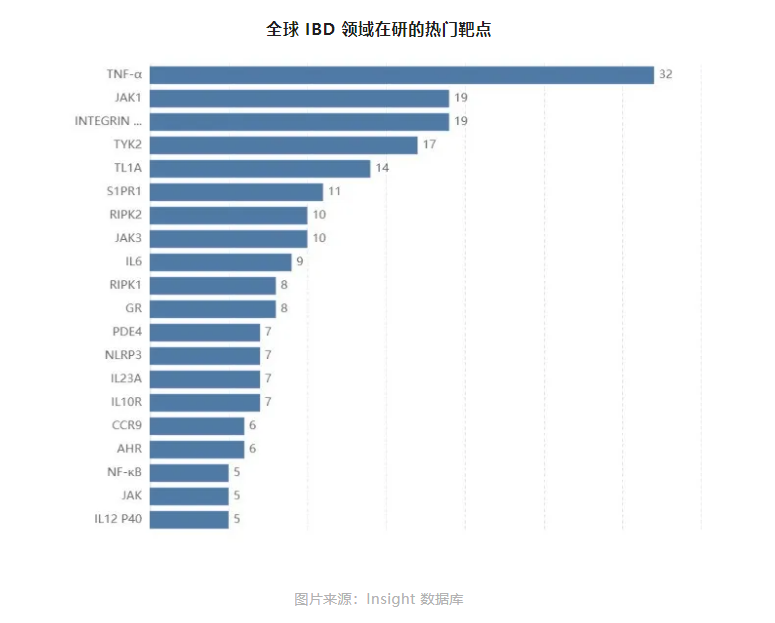
除TL1A、47外,其他自免类药物靶点也层出不穷,并已验证了成药性,包括靶向CD80/CD86的阿巴西普,靶向PDE-4的阿普米司特、罗氟司特、克立硼罗,靶向BAFF的贝利尤单抗、泰它西普(BAFF/APRIL)等。
目前,也有一些国内药企布局这类管线,其中济川药业引进恒翼生物的PDE-4抑制剂HPP737。以及海南海灵的PDE-4抑制剂Hemay005,均已处于III期临床。
另外,荣昌生物的泰它西普是全球首款、同类首创BLyS/APRIL双靶点新型重组TACI-Fc融合蛋白新药,可“双管齐下”阻止B细胞的异常分化和成熟,从而治疗自免疾病,目前已获批治疗系统性红斑狼疮、类风湿关节炎,针对重症肌无力、原发性干燥综合症、免疫球蛋白A肾病(IgAN)和视神经嵴髓炎频谱系疾病均已处于III期临床。
04
结语
国产自免药物的密集收获仅是序幕,商业化大战才是检验成果的试金石。在各个细分赛道上,国内药企需面对外资巨头的强劲挑战,以及国内同行的激烈竞争。
与此同时,潜力新靶点的不断涌现,也为国产自免药物的崛起提供了无限可能,未来或许还有更多惊喜等待揭晓。
参考资料:
1.各家公司的财报、公告、官微
2.Insight 数据库
3.民生证券、中信建投证券研报
$恒瑞医药(SH600276)$ $智翔金泰-U(SH688443)$ $康诺亚-B(HK|02162)$
@东方财富创作小助手 #李大霄:好股票或从2718区域开始反攻# #【有奖】中秋畅想大赛:我给大A送月饼# #A股并购重组活跃,能否成市场主线?# #第三次10亿元回购,药明康德股价稳了?#
本文作者可以追加内容哦 !

