9月23日,阿斯利康宣布,与第一三共株式会社共同研发的TROP2 ADC药物Datopotamab deruxtecan(Dato-DXD)在一项关键的III期乳腺癌治疗试验TROPION-Breast01研究中未能延长患者生存期,与化疗相比没有显著优势。
TROPION-Breast01 是一项全球性、随机、多中心、开放标签的 III 期试验,共纳入了700例既往接受内分泌治疗后疾病进展或不适合内分泌治疗的和接受过至少一种系统治疗的无法手术或转移性HR阳性、HER2低表达或HER2阴性(IHC 0,IHC 1+或IHC 2+/ISH-)乳腺癌患者,评估 Dato-DXd (6.0mg/kg) 对比研究者选择的单药化疗(艾日布林、卡培他滨、长春瑞滨或吉西他滨)在患者中的疗效和安全性。
该试验的双重主要终点是通过盲法独立中心审查和 OS 评估的 PFS。关键次要终点包括客观缓解率、缓解持续时间、研究者评估的 PFS、疾病控制率、首次后续治疗的时间和安全性。
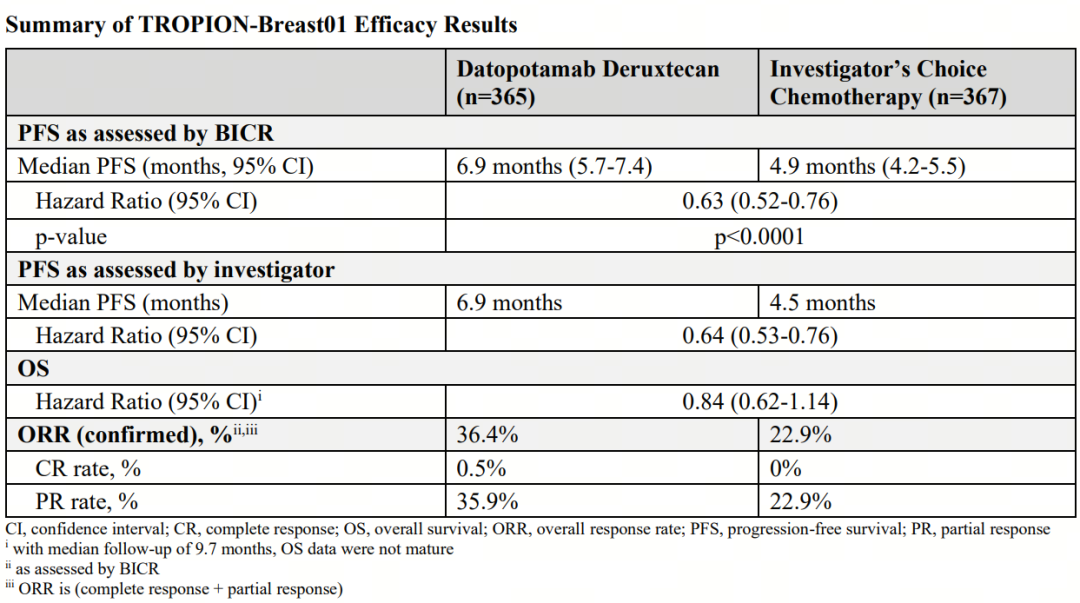
该研究的PFS主要终点已于2023年9月达到,相关数据也已在去年的ESMO大会上公布。结果显示,Datopotamab deruxtecan组患者的PFS相比单药化疗组显著延长(6.9 vs. 4.9个月,HR=0.63,P<0.0001),数据具有统计学意义和临床意义。当时,OS尚未达到具有统计学意义的结果(HR=0.84)。
阿斯利康此前已基于初次分析数据向FDA递交了Datopotamab deruxtecan的第2项BLA申请,今日公布的结果显示,Datopotamab deruxtecan组和单药化疗组之间的OS数据仍然不具备统计学意义。
对此,阿斯利康表示,由于在试验过程中批准了多种抗体药物偶联物(ADC),包括 Enhertu (trastuzumab deruxtecan),受试者在出现疾病进展或治疗中断后可能在后续接受了这些药物治疗,这是影响OS结果的可能原因。
阿斯利康肿瘤研发执行副总裁 Susan Galbraith 说:“过去几年中,转移性HR阳性乳腺癌的治疗取得了显著进展,为患者带来了福音。根据 TROPION-Breast01 结果,有证据表明 datopotamab deruxtecan 在这种情况下具有临床价值。我们将继续与监管机构进行讨论,并将从这些结果中获得的启示应用到datopotamab deruxtecan 治疗乳腺癌的临床开发计划。”
本文作者可以追加内容哦 !

