Q4有望上市的国产重磅创新药
随着国庆假期的到来,2024年悄然来到最后一个季度。
根据药明康德发布的《2024年上半年中国创新药领域亮点概览》,2024年上半年共有44个新药(含化学药品1类和5.1类;治疗用生物制品1类和3.1类)首次在中国获批上市,其中近20款来自恒瑞医药、海思科、正大天晴、康方生物、科济药业等中国公司。
鉴于创新药从NDA到获批上市通常需要1年的时间,笔者重点筛选了2023年下半年或之前在国内递交上市申请的创新药。同时,通过遴选创新性靶点和药物分子形式,筛选出7款值得重点关注的药物,包括吉卡昔替尼、艾玛昔替尼、SKB264、A166、先必新舌下片、D-1553和氘恩扎鲁胺等。
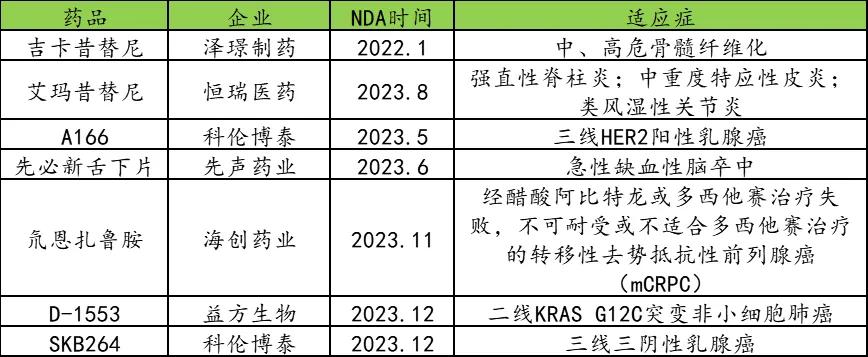
表:2024年Q4有望上市的国产重磅创新药
01
泽璟制药——吉卡昔替尼

吉卡昔替尼由泽璟制药研发,是一种新型JAK和激活素受体1(ACVR1)双抑制剂类药物,属于1类新药。吉卡昔替尼对Janus激酶包括JAK1、JAK2、JAK3和TYK2均具有显著的抑制作用,其中对JAK2和TYK2的抑制作用最为强劲。
2022年10月,泽璟制药提交的吉卡昔替尼片治疗中、高危骨髓纤维化适应症的NDA申请获得国家药监局受理,有望在Q4获批上市。
骨髓纤维化(MF)传统治疗方案仍停留在输血、雄激素、糖皮质激素、促红细胞生成素和免疫调节剂等,但上述方案均存在不良反应多、疗效有限和缓解持续时间短等问题。芦可替尼是目前唯一在我国获批用于治疗MF的JAK抑制剂,但临床研究数据显示,芦可替尼用于治疗MF患者的3~4级贫血发生率达47.6%。而吉卡昔替尼的Ⅲ期临床试验的安全性数据显示,与羟基脲组相比,贫血发生率分别为25.5%和43.5%,反映出吉卡昔替尼良好的安全性。
在疗效的对比上,吉卡昔替尼组(47例)治疗24周时SVR35患者比例高于羟基脲组(23例),分别为72.3%、17.4%(P≤0.000
1),而芦可替尼治疗欧美和我国MF患者的24周SVR35患者比例分别为41.9%(COMFORT-Ⅰ研究)、32%(COMFORT-Ⅱ研究)和27.0%[A2202研究(中国人群)。总体而言,吉卡昔替尼在改善脾脏大小和体质性症状方面的结果与其他JAKi相当或更佳。
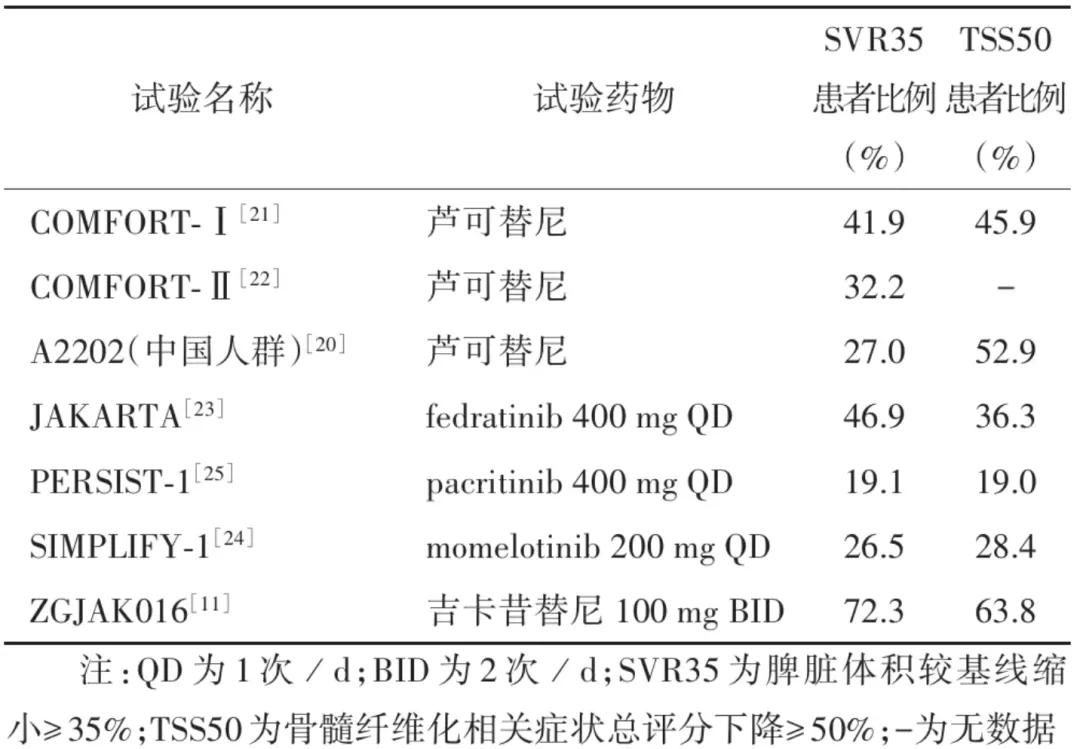
图:JAK抑制剂初治骨髓纤维化患者的疗效对比
数据来源:《白血病·淋巴瘤》
02
恒瑞医药——艾玛昔替尼

硫酸艾玛昔替尼(SHR0302)是恒瑞医药旗下一种高选择性的JAK1抑制剂,可通过抑制JAK1信号传导发挥抗炎和抑制免疫的生物学效应。
硫酸艾玛昔替尼已递交四项适应症,分别是强直性嵴柱炎(2023.8)、中、重度特应性皮炎(2023.11)、类风湿性关节炎(2023.11)及重症斑秃(2024.9)。鉴于前三项适应症均于2023年下半年递交上市申请,预计艾玛昔替尼多个适应症有望集中落地。
在2024美国皮肤病学会年会(AAD)上,恒瑞医药披露了艾玛昔替尼治疗中重度特应性皮炎(AD)的3期研究结果。研究数据表明:中重度特应性皮炎患者使用艾玛昔替尼治疗16周,皮损与瘙痒症状均得到了显著改善,52周的长期随访证实,药物疗效长期持续,且整体安全性良好。
03
科伦博泰——SKB264和A166

芦康沙妥珠单抗(SKB264)和博度曲妥珠单抗(A166)是科伦博泰旗下两款关注度极高的ADC产品。
芦康沙妥珠单抗 (SKB264/MK-2870/sac-TMT)是一种靶向晚期实体瘤的新型人滋养细胞表面抗原2(TROP2)
ADC。SKB264采用新型连接子进行开发,其通过偶联一种贝洛替康衍生的拓扑类异构酶I抑制剂作为有效载荷,药物抗体比(DAR)达到7.4。
SKB264已向国家药监局递交两项上市申请。2023年12月,国家药监局药审中心受理了SKB264用于治疗既往至少接受过两种系统治治疗的不可切除的局部晚期或转移性TNBC成人患者的NDA。2024年8月,国家药监局药审中心受理了SKB264用于治疗EGFR-TKI和含铂化疗治疗失败的局部晚期或转移性EGFR突变NSCLC患者的NDA。
SKB264治疗先前接受过两种系统治治疗的不可切除的局部晚期或转移性TNBC成人患者的Ⅲ期OptiTROP-Breast01研究结果于2024年ASCO公布,与医生选择的化疗(艾立布林、长春瑞滨、卡培他滨或吉西他滨)相比,ORR分别为45.4%和12%,中位PFS分别为6.7个月和 2.5个月,疾病进展或死亡风险降低68%(HR=0.32,95%
CI:0.22~0.44;P<0.001)。总的来看,作为中国首个原研抗 TROP2
ADC,芦康沙妥珠单抗在晚期TNBC 患者中展示出了优异的疗效和可控的安全性

图:SKB264研发进展
数据来源:科伦博泰官网
A166(博度曲妥珠单抗)是一款处于NDA注册阶段的差异化HER2
ADC,用于治疗晚期HER2+实体瘤。A166毒素分子针对肿瘤细胞的作用机理是微管抑制,通过抑制微管影响细胞分裂周期,导致G2/M期细胞周期阻滞,诱导细胞凋亡。
2023年5月,科伦博泰向国家药监局提交了A166的NDA,适应症为3L+晚期HER2+乳腺癌。在2022年ASCO大会上,科伦博泰公布的A166治疗经过四线治疗的HER2+乳腺癌患者的1期剂量扩展研究的更新数据显示:4.8mg/kg组客观缓解率(ORR)为73.9%,中位PFS为12.3个月;6.0mg/kg组ORR为68.6%,中位PFS为9.4个月。
安全性方面,A166不良反应整体可控,3级治疗相关不良事件(TRAE)为角膜上皮病变(34.5%)、视力模糊(22.4%)和溃疡性角膜炎(10.3%)。不过发生眼部不良事件的患者经用药调整和对症治疗后,均可恢复。

图:A166研发进展
数据来源:科伦博泰官网
04
先声药业——先必新舌下片

先必新舌下片是一种脑细胞保护剂,含依达拉奉和右莰醇两种活性成分,具有抗氧化、抗炎和协同增效作用,能够显著减少急性缺血性脑卒中导致的脑细胞损伤。该药独特的舌下片配方在舌下与唾液接触后即可迅速崩解,通过舌下静脉丛快速吸收进入血液发挥疗效,便于急性缺血性脑卒中患者发病后后第一时间急救,以及出院后也可居家用药。
2023年6月28日,先必新舌下片新药上市申请(NDA)获国家药品监督管理局(NMPA)受理,首个适应症为用于改善急性缺血性脑卒中所致的神经症状、日常生活活动能力和功能障碍。
先必新舌下片是全球脑卒中治疗领域首个被FDA认定为突破性疗法的创新药。2024年9月2日,先声药业宣布,先必新舌下片获美国食品药品监督管理局(FDA)“突破性疗法认定”,用于治疗急性缺血性脑卒中(AIS)。这是全球脑卒中治疗领域首个被FDA认定为突破性疗法的创新药。

图:先必新注射液+舌下片的协同策略
数据来源:先声药业宣传资料
05
海创药业——氘恩扎鲁胺

氘恩扎鲁胺(HC-1119)是海创药业研发用于治疗mCRPC的1类新药,是第二代雄激素受体(AR)拮抗剂恩扎卢胺的氘代药物,作为海创药业自主研发的AR抑制剂,拟用于治疗转移性去势抵抗性前列腺癌,是前列腺癌领域首个氘代机制的创新药物,优化了药物的PK/PD特性,药物安全性更佳。
氘恩扎鲁胺的新药上市申请于2023年11月获国家药品监督管理局(NMPA)药品审评中心(CDE)受理,用于经醋酸阿比特龙或多西他赛治疗失败,不可耐受或不适合多西他赛治疗的转移性去势抵抗性前列腺癌(mCRPC)患者。
氘恩扎鲁胺的Ⅲ期临床研究结果披露于2023年ASCO,417例患者随机纳入氘恩扎鲁胺组和安慰剂组,中位rPFS分别为5.55个月和3.71个月,中位OS分别为14.98个月和11.24个月(HR为0.88)。
06
益方生物——D-1553

Garsorasib(D-1553)是益方生物自主研发的新型KRAS
G12C抑制剂。2023年12月,益方生物宣布D-1553的新药上市申请获得受理,用于既往经一线系统治疗后疾病进展或不可耐受的、并且经检测确认存在KRAS
G12C突变的局部晚期或转移性非小细胞肺癌的治疗。
在2024年WCLC上,上海市胸科医院的李子明教授以口头报告形式公布了garsorasib治疗KRAS
G12C突变的非小细胞肺癌(NSCLC)的2期研究最新进展:客观缓解率(ORR)为52%,疾病控制率(DCR)为88.6%,中位缓解持续时间(DOR)为12.5个月,中位无进展生存期(PFS)为9.1个月,中位总生存期(OS)为14.1个月。
益方生物和正大天晴就D-1553国内商业化权益展开合作。2023年8月,益方生物与正大天晴药业集团股份有限公司就Garsorasib签署《许可与合作协议》。根据该协议,益方生物授予正大天晴药业集团股份有限公司在协议期限内对Garsorasib(D-1553)产品在中国大陆地区开发、注册、生产和商业化的独家许可权。
来源: bioSeedin柏思荟
本文作者可以追加内容哦 !


