国内首款三阴性乳腺癌PD-L1伴随诊断试剂盒获批上市
迈杰转化医学2024-11-01 14:56江苏
2024年10月28日,迈杰转化医学研究(苏州)有限公司(以下简称“迈杰医学”),一家专注于通过转化医学为癌症精准医疗提供整体解决方案的创新企业,宣布其与君实生物合作开发的PD-L1(JS311)抗体试剂(免疫组织化学法)(商品名:迈泽康),一款同步开发的原研伴随诊断试剂盒获得国家药品监督管理局(NMPA)批准,该试剂盒成为首款经NMPA批准的适用于三阴性乳腺癌(TNBC)患者的PD-L1伴随诊断产品。可通过检测三阴性乳腺癌患者组织中的PD-L1蛋白表达,用于特瑞普利单抗(拓益)药物的伴随诊断。

该伴随诊断产品的获批是基于君实生物发起的针对PD-L1阳性的复发或转移性TNBC患者的关键性Ⅲ期临床研究(TORCHLIGHT研究),经过PD-L1(JS311)抗体试剂检测确认的PD-L1阳性TNBC患者接受特瑞普利单抗联合化疗,获得了显著的临床改善,证实了安全性和有效性,这为伴随诊断产品获批提供了充分的药效学证据。同时,迈杰医学自主研发的PD-L1(JS311)抗体试剂盒亦同步开发完成精密度、准确度、特异性、可重复性等实验室和临床验证工作。君实生物与迈杰医学的共同努力,为PD-L1阳性的复发或转移性TNBC患者提供了一线治疗新标准,进一步推动了个性化肿瘤治疗的发展。
TORCHLIGHT研究,是国内首个在晚期TNBC免疫治疗领域取得阳性结果的III期注册研究,中期分析数据于2024年1月,发表于国际顶尖医学期刊《自然-医学》(Nature Medicine,影响因子:58.7)。结果显示,与注射用紫杉醇(白蛋白结合型)相比,特瑞普利单抗联合注射用紫杉醇(白蛋白结合型)用于首诊IV期或复发转移性TNBC患者可显著延长PD-L1阳性人群的无进展生存期(PFS),总生存期(OS)也有获益趋势,实现了中国晚期TNBC免疫治疗零的突破。主要数据如下图1-2
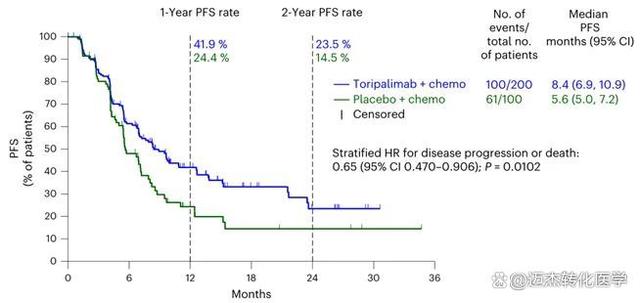
图1:PD-L1阳性TNBC患者的无进展生存(PFS)数据[1]
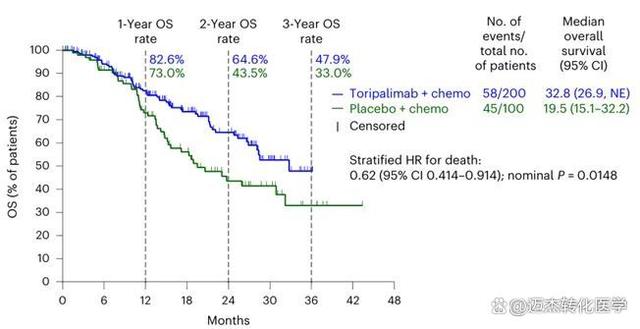
图2:PD-L1阳性TNBC患者的总生存(OS)数据[1]
迈杰医学的非小细胞肺癌PD-L1伴随诊断试剂盒(克隆号:E1L3N)已于2022年获批上市,而此次三阴性乳腺癌PD-L1(克隆号:JS311)伴随诊断试剂盒的获批进一步拓展了PD-L1在多种适应症中的应用,目前针对食管癌和胃癌的适应症也正在开展临床试验。此外,迈杰医学于2024年9月自主研发的“免疫组化数字病理图像处理软件”也成功获批上市,为未来PD-L1在免疫治疗领域带来了更多的可能与希望。
参考文献
[1] Z Jiang, Q Ouyang,et al. Toripalimab plusnab-paclitaxel in metastatic or recurrent triple-negative breast cancer: arandomized phase 3 trial. Nat Med. 2024 Jan; 30(1):249-256.
关于迈杰医学
迈杰转化医学研究(苏州)有限公司(以下简称为:迈杰医学)于2013年成立,前身为QIAGEN转化医学研究中心。作为伴随诊断整体解决方案领导者,拥有综合转化医学技术支持药物临床转化、伴随诊断产品(CDx)开发和用药指导检测三大业务,基于基因组学、蛋白组学、细胞组学,病理组学以及大数据与AI等综合技术平台,一流的产品开发团队与完善的研发流程,以及完善的质量体系(涵盖CAP、CNAS ISO 17025、ISO13485、GMP、GSP等), 迈杰医学围绕靶向治疗,免疫治疗及细胞/基因治疗,赋能药物临床转化研究并开发对应的伴随诊断产品,支持药物上市后的精准用药。迈杰医学已与全球400+创新药企及技术公司展开合作,已开发验证了数百个生物标记物及方法学,支持上百个药物临床试验。截至目前共有20+款产品获得药监批准,涵盖实体肿瘤和血液肿瘤,其中包括国内首个获批的JAK2-V617F突变检测试剂盒及用于免疫治疗的PDL-1检测试剂盒;以及8款CE认证产品。并且免疫组化数字病理图像处理软件成功获批二类医疗器械注册证。同时,迈杰医学有40多款在研 CDx/IVD产品管线其中有10个正在临床试验中。基于独创的一体化商业模式,迈杰医学已迅速发展成为中国伴随诊断整体解决方案创新企业,解决创新药物的研发痛点及患者的用药痛点,助力精准医疗。
举报/反馈
相关搜索
本文作者可以追加内容哦 !

