胰腺导管腺癌(PDAC)以其高死亡率和低生存率成为最致命的癌症之一。随着对肿瘤微环境(TME)及其在癌症进展中作用理解的深入,科学家们正在探索针对癌症相关成纤维细胞(CAF)的新治疗策略。一项发表在ACS Nano期刊的研究性文章Effect of Bioactive Black Phosphorus Nanomaterials on Cancer-Associated Fibroblast Heterogeneity in Pancreatic Cancer,利用生物活性黑磷(BP)纳米材料来影响中的CAF异质性,并揭示了其潜在的临床价值。
研究背景
胰腺导管腺癌(PDAC)患者的五年生存率仅为8%,预计到2030年将成为第二大癌症致死原因。以吉西他滨为基础的化疗是治疗PDAC的主要手段,但其疗效有限,因此开发新的治疗手段至关重要。
近年来,研究者开始关注肿瘤微环境中的癌症相关成纤维细胞(CAF),它们不仅促进肿瘤生长,还参与转移和化疗耐药性。CAF在基质中占据主导地位,通过分泌多种因子和细胞外基质成分支持肿瘤发展。鉴于CAF的异质性及其对肿瘤进展的不同影响,针对这些细胞的策略成为潜在的新治疗方向。
与此同时,纳米材料因其独特的性质,在生物医学领域展现出巨大潜力。特别是生物活性黑磷(BP),作为一种由单一磷元素组成的天然生物活性纳米材料,不仅具有优良的物理和化学性质,而且具有生物降解性,能够降解成为磷酸盐离子。BP被摄取和降解后,细胞内磷酸盐离子水平的剧烈变化可能导致纳米生物界面上的各种生物学效应,这对包括CAF在内的许多细胞的生物学过程都具有很强的调控作用。
此外,有研究显示BP具有免疫增强佐剂的作用,该团队之前也尝试构建BP和吉西他滨的药物传递系统治疗PDAC,发现BP能够协同吉西他滨抑制细胞周期增强抗癌作用。但是BP对PDAC中CAF的作用尚没有报道。因此,在这篇文章中,该团队旨在探索生物活性BP纳米材料对中异质性CAF的影响,为开发更有效的PDAC治疗方案提供新思路。
研究设计与结果
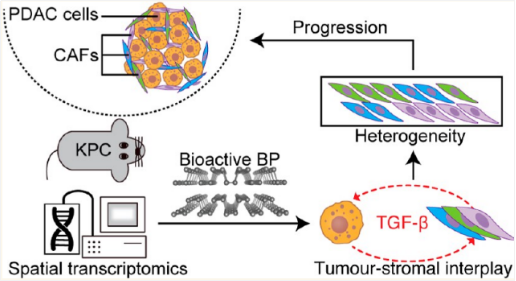
本研究利用空间转录组学技术,在小鼠模型中绘制了生物活性黑磷纳米材料处理后原发性和肝转移性PDAC的基因表达谱图。结果显示,生物活性黑磷抑制CAF激活,减少炎症型和肌成纤维细胞型CAF数量,影响肿瘤基质相互作用,并下调Mki67和Tgfb1等关键基因表达,表明其在调控CAF异质性中的重要作用。
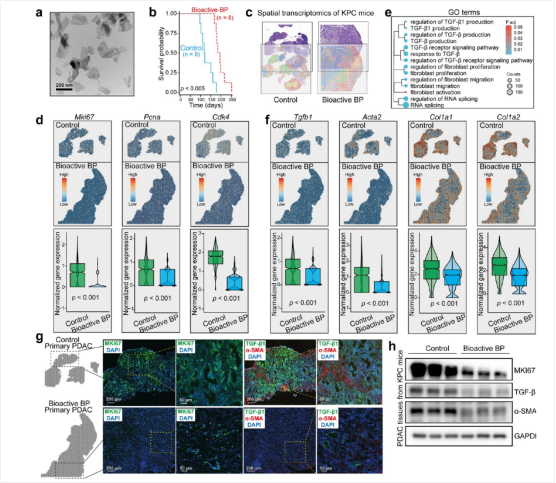 图1:生物活性BP抑制PDAC进展
图1:生物活性BP抑制PDAC进展
研究人员通过透射电子显微镜(TEM)表征生物活性BP纳米材料(图1a),并在携带PDAC的KPC小鼠中尾静脉注射。结果显示,治疗后小鼠生存时间显著延长(图1b)。空间转录组测序技术发现,PDAC组织中肿瘤进展标志物Mki67、Pcna和Cdk4的表达下降(图1d),表明生物活性BP可能通过抑制这些基因减缓PDAC进展(图1e)。GO分析显示,处理组的差异表达基因主要富集于TGF-调控通路(图1f),这与CAF的去活化一致,显示出生物活性BP在抑制胰腺导管腺癌进展中的潜力。
图2:生物活性BP参与了TGF-通路的调控
紧接着研究人员使用bulk RNA测序技术分析了HM-SUIT2细胞在梯度浓度的生物活性BP处理后的转录组变化(图2a)。结果显示,差异表达基因(DEGs)主要富集于TGF-调控和RNA加工相关的途径(图2b-c)。通过nanopore长读RNA测序技术,鉴定了生物活性BP诱导的可变剪接基因,这些基因主要富集于TGF-通路(图2e),表明生物活性BP可能通过调控RNA剪接影响TGF-通路(图2f)。这在另一种PDAC细胞系PANC-1中也得到了验证。这些研究表明生物活性BP在PDAC细胞中通过调控TGF-通路发挥显著的生物学效应。
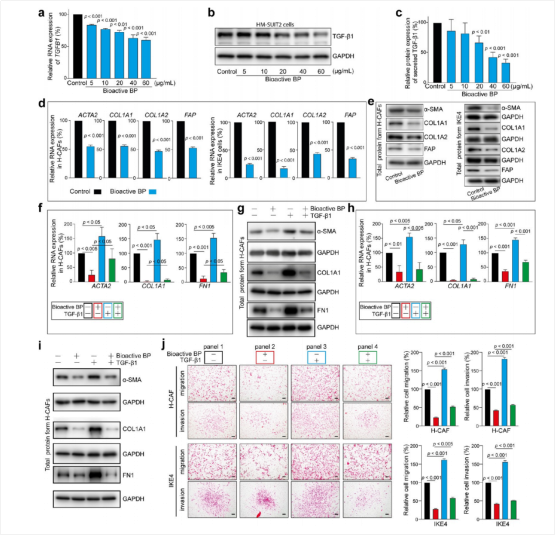 图3:生物活性BP通过TGF-1介导的肿瘤-间质相互作用抑制CAF的激活
图3:生物活性BP通过TGF-1介导的肿瘤-间质相互作用抑制CAF的激活
实时定量PCR分析、蛋白质印迹分析验证了生物活性BP抑制PDAC细胞TGFB1表达(图3a-b)。ELISA检测也验证了TGF-1蛋白分泌减少(图3c)。PDAC和CAF细胞非接触共培养实验显示,生物活性BP处理PDAC后使CAF激活标志物降低(图3d-e),用重组TGF-1处理可恢复这些标志物表达(图3f-g)。与生物活性BP处理后的PDAC细胞共培养也会抑制CAF的迁移和侵袭,且能够被TGF-1恢复(图3j)。这些结果表明,生物活性BP通过抑制TGF-1信号通路来使CAF去活化,提供了其在癌症治疗中的新思路。
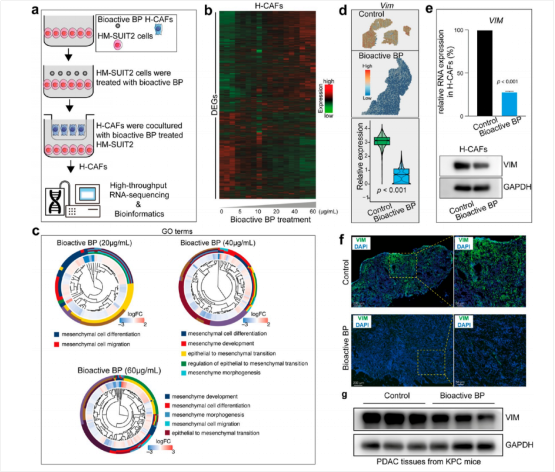 图4:生物活性BP通过肿瘤-间质相互作用抑制CAF间充质表型
图4:生物活性BP通过肿瘤-间质相互作用抑制CAF间充质表型
RNA测序发现,与生物活性BP处理PDAC细胞共培养后,CAF的差异表达基因(DEGs)主要富集在间质GO术语中,随着生物活性BP浓度的增加,这些基因显著增加(图4b)。生物活性BP处理KPC小鼠后,Vimentin(一种典型的间质标志物)的表达显著下调(图4d),RT-PCR和Western blot也显示Vimentin表达下降(图4e)。
利用空间转录组数据,在KPC小鼠PDAC肿瘤组织识别出CAF的不同亚群,包括apCAF、iCAF和myCAF。通过CellChat分析,发现生物活性BP处理后,不同CAF亚型之间的相互作用减弱,且PDAC细胞和CAF之间以及不同CAF亚型之间的TGF-通路相关配体和受体相互作用也被抑制(图5d-f)。同时,三类CAF的标志物也发生下调(图5h),其中iCAF和myCAF的细胞数量在BP处理后减少(图5i)。此外,拟时序分析显示BP处理让CAF显示出更复杂的分化轨迹(图5g),且可能与TGF-通路抑制有关。综上所述,生物活性BP通过调控肿瘤-基质相互作用来抑制CAFs的间质表型,为胰腺导管腺癌的治疗提供了新的思路。
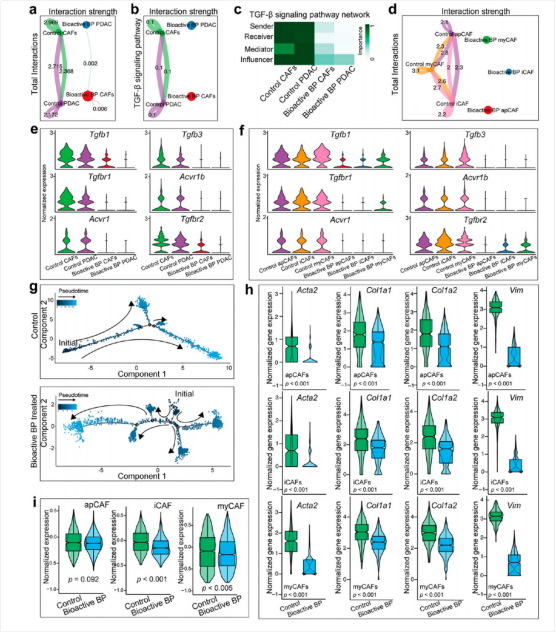 图5:生物活性BP影响CAF的分化轨迹和异质性
图5:生物活性BP影响CAF的分化轨迹和异质性
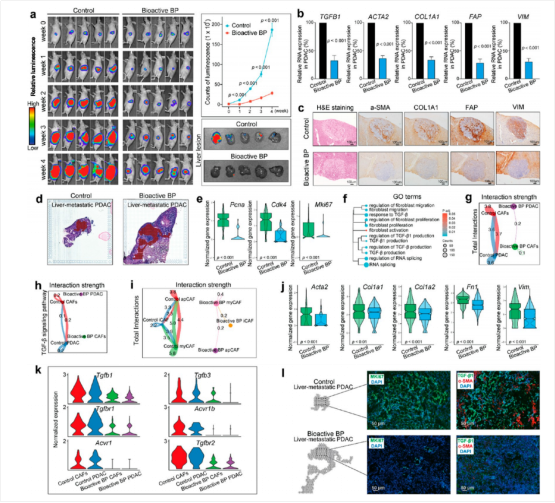 图6:生物活性BP通过失活CAF来抑制PDAC的肝转移
图6:生物活性BP通过失活CAF来抑制PDAC的肝转移
最后,研究人员进一步研究了生物活性BP对PDAC肝转移的影响。结果显示,BP处理组的小鼠PDAC进展和肝转移潜力显著降低(图6a)。在处理的小鼠中,PDAC原发灶和肝专业灶组织中的CAF激活标志物TGFB1、ACTA2、COL1A1、FAP和VIM的表达显著下调(图6b&c),验证了生物活性BP同时抑制PDAC原发灶和转移灶CAF的激活。利用空间转录组测序技术分析了生物活性BP处理对肝转移PDAC组织中的基因表达的影响,发现肿瘤进展标志物和CAF激活标志物表达均显著下调(图6e-f&6j),免疫荧光验证了这一结果(图6l)。
对差异表达基因进行GO分析和基因集富集分析,发现DEGs主要富集于与TGF-调控相关通路和CAF调控相关通路(图6f)。CellChat分析显示,处理后各CAF细胞之间的相互作用以及PDAC和CAF之间TGF-通路配体和受体表达相互作用减弱(图6i-k)。这些结果表明,生物活性BP对肝转移灶的抑制作用与PDAC原发灶类似,能够通过抑制CAFs的激活来显著抑制PDAC进展和肝转移的潜力。
拓展延伸
除了外,BP在其他类型癌症的治疗中也具有潜在应用价值。
1. 抑制肿瘤细胞增殖和转移
黑磷材料通过抑制肿瘤细胞增殖相关基因的表达,如Mki67、Pcna和Cdk4,从而减缓肿瘤进展。这些基因在多种癌症中都起到关键作用,因此黑磷材料在抑制这些基因方面具有广泛的应用前景。
2. 调控TGF-通路
黑磷材料能够显著降低Tgfb1的mRNA和蛋白水平,抑制TGF-通路。这一特性使得黑磷材料在癌症治疗中具有独特的优势,尤其是在那些依赖TGF-通路生长和转移的癌症中。
3. 抑制CAF的恶性表型
黑磷材料通过抑制CAF中的TGF-1信号通路,减少炎症型CAF和肌成纤维细胞型CAF的数量,从而减少肿瘤基质的相互作用。这为黑磷材料在癌症治疗中的应用提供了新的思路。
4. 诱导肿瘤细胞凋亡
除了对癌细胞的影响,黑磷材料还能够诱导肿瘤细胞凋亡,并抑制肿瘤血管生成。这种双重作用机制使其在癌症综合治疗中具有潜在的应用价值。
5. 与其他治疗方法联合使用
黑磷材料可以与其他治疗方法(如化疗、放疗和免疫治疗)结合使用,提高治疗效果。例如,它可以与化疗药物联合使用,增强化疗效果;也可以与放疗联合使用,减少放疗对正常组织的损伤。
临床应用与展望
这项关于生物活性黑磷的研究为理解和治疗提供了一个全新的视角。通过特异性地调节CAF的功能状态,有望克服传统疗法所面临的局限性,比如提高化疗敏感度、减缓疾病进程甚至逆转病情。未来的研究方向可能包括优化给药方式、评估长期安全性以及开展更大规模的人体试验,以期早日实现从实验室到病床的应用转化。
通过上述内容可以看出,生物活性黑磷纳米材料作为一种新兴的抗癌工具展现出了巨大潜力。随着对其机制的深入了解和技术的进步,我们期待看到更多基于此类创新材料的成功案例出现,为抗击带来希望之光。
本文作者可以追加内容哦 !

