近日,葛兰素史克(GSK)与映恩生物就一项ADC药物(DB-1324),达成独家授权协议。根据协议,GSK将获得该药全球(不包括中国大陆、香港地区和澳门地区)的独家授权,以推进该ADC药物的研发与商业化进程。本次交易总金额高达10.05亿美元(约合人民币73亿元)。
这是继GSK的ADC药物Blenrep在美国市场撤市后,其在ADC领域的又一重磅布局。
73亿元下注,GSK正「卷土重来」。
01 收获「ADC猛将」
DB-1324是一种创新ADC分子,基于映恩生物独有且经过临床验证过的Duality Immune Toxin Antibody Conjugates(DITAC)平台开发而成。
目前该药还处于临床前开发阶段,其研究方向可能针对胃肠道(GI)癌症。全球胃肠道癌症患者还有大量未满足的临床需求,GI癌症患者占所有癌症相关死亡人数的35%,约占全球癌症发病率的26%。
此外,该ADC药物有潜力与GSK多个抗肿瘤产品联合用药,从而战略性地补充GSK的肿瘤产品组合。

图1 DITAC平台
图片来源:映恩生物官网
根据协议条款,GSK将预先支付3,000万美元预付款及其他行权前里程碑付款以获得在全球范围内(中国大陆、香港地区和澳门地区除外)推进DB-1324研发和商业化的独家授权许可。如果GSK行使许可权,映恩生物将收取行权费以及后续在开发、法规注册和商业化不同阶段的里程碑付款,最高可达9.75亿美元。商业化成功后,GSK将对全球净销售额(中国大陆、香港地区和澳门地区除外)支付不同比例的分级特许权使用费,并从中国大陆、香港地区和澳门地区的净销售额中获得特许权使用费。
DB-1324是GSK收购的又一员「ADC猛将」,与映恩生物达成交易,对于GSK补充其ADC布局有着重要意义。同时,也反映出中国生物制药公司在ADC研发方面的实力逐渐受到国际认可,中国已成为全球ADC研发的重要力量。
02 GSK「卷土重来」
Blenrep是一种靶向B细胞成熟抗原(BCMA)的抗体偶联(ADC)药物,由人源化抗BCMA单克隆抗体与细胞毒性载荷澳瑞他汀F(auristatin F)通过不可切割的连接子偶联而成,它可以通过多重作用机制消除骨髓瘤细胞。
该药于2017年获得美国FDA授予的突破性疗法认定,2020年8月5日,Blenrep作为单药疗法获得FDA加速批准,治疗既往接受过至少4种疗法的复发/难治性多发性骨髓瘤患者,2020年8月25日,获得欧洲药品管理局(EMA)批准。根据GSK彼时新闻稿,这是全球首个获批的靶向BCMA的ADC疗法。
然而,2022年11月7日,GSK宣布Blenrep在临床III期DREAMM-3试验中未达到其临床终点,这是一项“头对头”的优效性试验,研究对比了Blenrep单药与泊马度胺联合低剂量地塞米松(PomDex)的疗效。
结果显示,Blenrep组比对照组的中位无进展生存期(mPFS)分别为11.2个月和7个月,虽然Blenrep组更长,但不显著。Blenrep组与对照组ORR分别为41%和36%,12个月DoR率分别为76.8%和48.4%,中位DoR未达到,安全性方面与此前报告一致。在这项临床研究中,GSK采用了无进展生存期(PFS)为替代性终点,但仍未达到研究终点。FDA对Blenrep的加速批准基础产生了疑问,认为最终获益未能被证明。2022年12月,Blenrep撤出美国市场。
尽管Blenrep在美国市场撤市,但GSK并未放弃该药物,一直在其他地区推进Blenrep的可及性,并积极探索新的临床试验数据,以支持该药物重新回归市场。2024年6月,GSK在2024 ASCO大会上公布Blenrep两项3期试验DREAMM-7与DREAMM-8研究的结果,其中,DREAMM-7评估了Blenrep+硼替佐米+地塞米松(BorDex)联合使用,结果显示DREAMM-7研究达成主要终点,接受Blenrep联合疗法患者的中位无进展生存期(PFS)为36.6个月,较活性对照组患者的13.4个月多了近2年,接受Blenrep联合疗法患者的疾病进展或死亡风险降低了近60%。
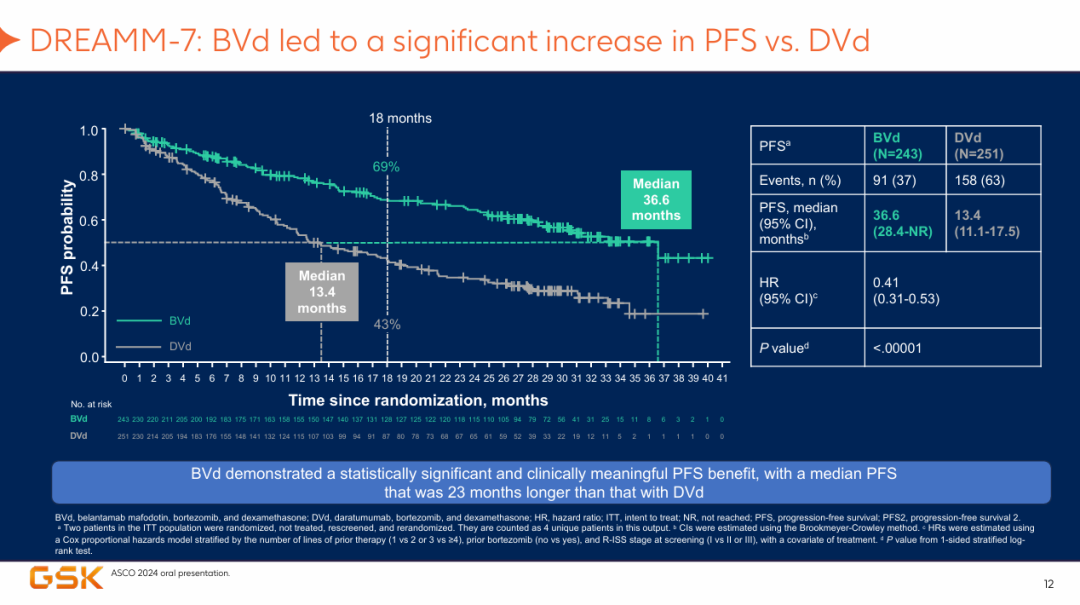
图2 DREAMM-7 PFS结果
图片来源:GSK
另外,在DREAMM-8试验中,Blenrep+泊马度胺+地塞米松的联合疗法也表现出显著意义的统计学及PFS获益。PFS为21.7个月,Blenrep联合疗法患者的疾病进展或死亡风险降低了近50%,达成该试验的主要终点。这些积极结果重新使GSK重新对Blenrep燃起了希望,并促使公司重新提交了该药物的上市申请。
10月15日,CDE官网最新公示,葛兰素史克申报的注射用belantamab mafodotin拟纳入优先审评,针对适应症为与硼替佐米和地塞米松联合,用于治疗既往接受过至少一种治疗的多发性骨髓瘤成年患者。此次这款靶向BCMA的ADC疗法在中国拟纳入优先审评,意味着该产品有希望加速来到患者身边。
03 持续加码
除了Blenrep之外,GSK在ADC领域进行了广泛的布局。
表1 GSK在ADC领域的部分license-in交易
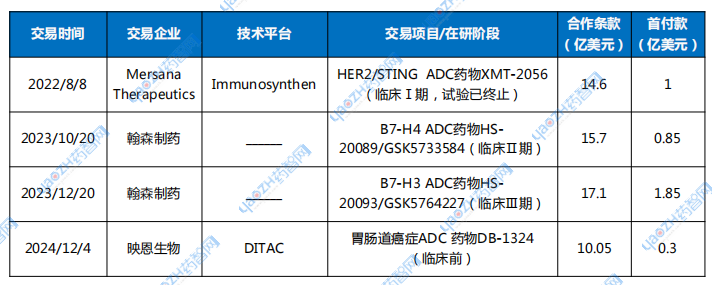
数据来源:公开资料整理
2022年8月8日,GSK与Mersana Therapeutics达成协议,GSK获得共同开发和商业化XMT-2056的独家选择权。根据协议条款,Mersana将获得1亿美元的预付款。如果GSK行使其选择权,Mersana也有资格获得高达13.6亿美元的里程碑付款,使得该交易成为迄今为止临床前ADC资产规模最大的交易之一。
XMT-2056是Mersana首个进入临床的Immunosynthen STING激动剂ADC候选产品,2023年3月13日,GSK宣布XMT-2056的I期临床试验出现治疗相关的5级(致命)严重不良事件(SAE)暂停临床试验。
2023年10月20日,GSK宣布与翰森制药达成合作,授予对方自研B7-H4 ADC新药HS-20089的全球独占许可(不含中国大陆、香港、澳门及台湾地区)。根据许可协议,翰森将收取8500万美元首付款,并有资格收取最多14.85亿美元的里程碑款项。商业化后GSK还将就许可地区内的全球净销售额支付分级特许权使用费。
同年12月,GSK再次宣布与翰森制药达成管线HS-20093(B7H3 ADC)全球权益合作,GSK将获得开发、生产及商业化HS-20093的全球独占许可(不含中国大陆、香港、澳门及台湾地区)。根据许可协议,翰森生物将收取1.85亿美元首付款,并有资格就该产品收取最多15.25亿美元的相关事件达成时的里程碑付款。
HS-20089是一种B7-H4靶向ADC,其有效载荷为拓扑异构酶抑制剂(TOPOi)。目前正在中国进行用于治疗晚期实体瘤的Ⅱ期临床研究;HS-20093是一种B7-H3靶向ADC,由全人源抗B7-H3单抗与拓扑异构酶抑制剂(TOPOi)有效载荷共价连接而成,目前正在中国开展用于小细胞肺癌的Ⅲ期临床研究,以及肉瘤、头颈癌、食管癌及其他实体瘤的多项Ⅰ期及Ⅱ期临床研究。
此次与映恩生物达成合作协议,对GSK进一步完善其抗体偶联药物(ADC)产品布局具有关键意义。这四项重要交易如同有力的战略补给,将为GSK在多个癌症适应症领域的ADC布局增添强大助力。
04 结语
随着癌症发病率的不断上升和对精准治疗需求的增加,ADC药物市场呈现出巨大的增长潜力。GSK凭借其广泛的ADC产品管线,有望在未来的市场竞争中占据有利地位。
$恒生医疗ETF(SH513060)$$药明康德(HK|02359)$$药明合联(HK|02268)$#美最终版NDAA未纳入生物安全法案#
来源:药智网
免责声明:转载内容仅供读者参考,版权归原作者所有,内容为作者个人观点,不代表其任职机构立场及任何产品的投资策略。本文只提供参考并不构成任何投资及应用建议。如您认为本文对您的知识产权造成了侵害,请立即告知,我们将在第一时间处理。
本文作者可以追加内容哦 !

