
12月25日,$翰宇药业(SZ300199)$发布公告,称其与Hikma Pharmaceuticals联合申报的利拉鲁肽注射液新药简略申请(ANDA)已获 FDA 批准,作为饮食和运动辅助改善成人和 10 岁及以上儿童 2 型糖尿病患者的血糖控制。

利拉鲁肽(liraglutide-1)是人胰高血糖素样肽 1(GLP-1)的类似物,GLP-1 受体是重要的药物靶点,具有多种生理功能:血糖依赖性促进 胰岛素分泌、保护胰岛 细胞、延迟胃排空降低食欲等。据摩熵医药数据库显示,利拉鲁肽注射液在2023年全国院内市场的销售逼近17亿元,同比增长达21.7%。
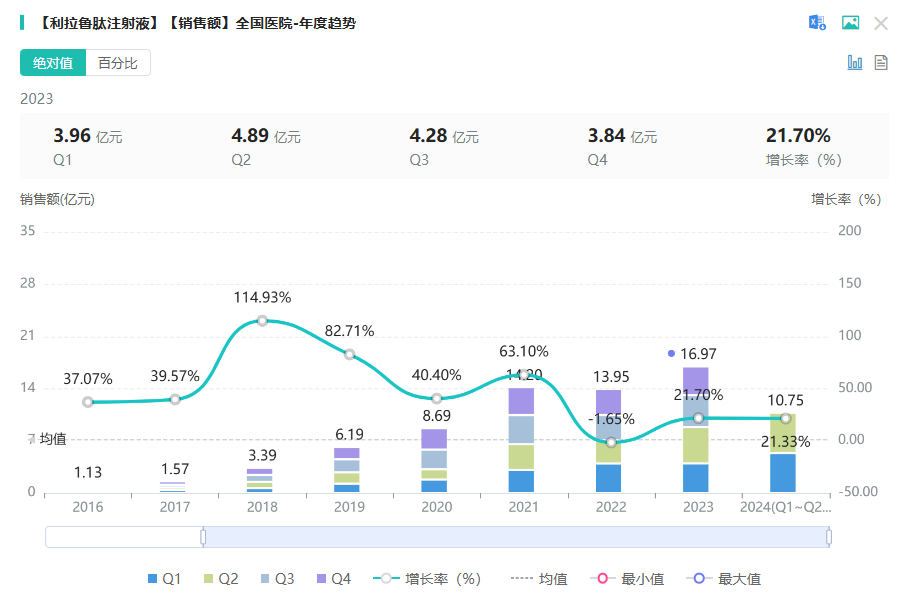
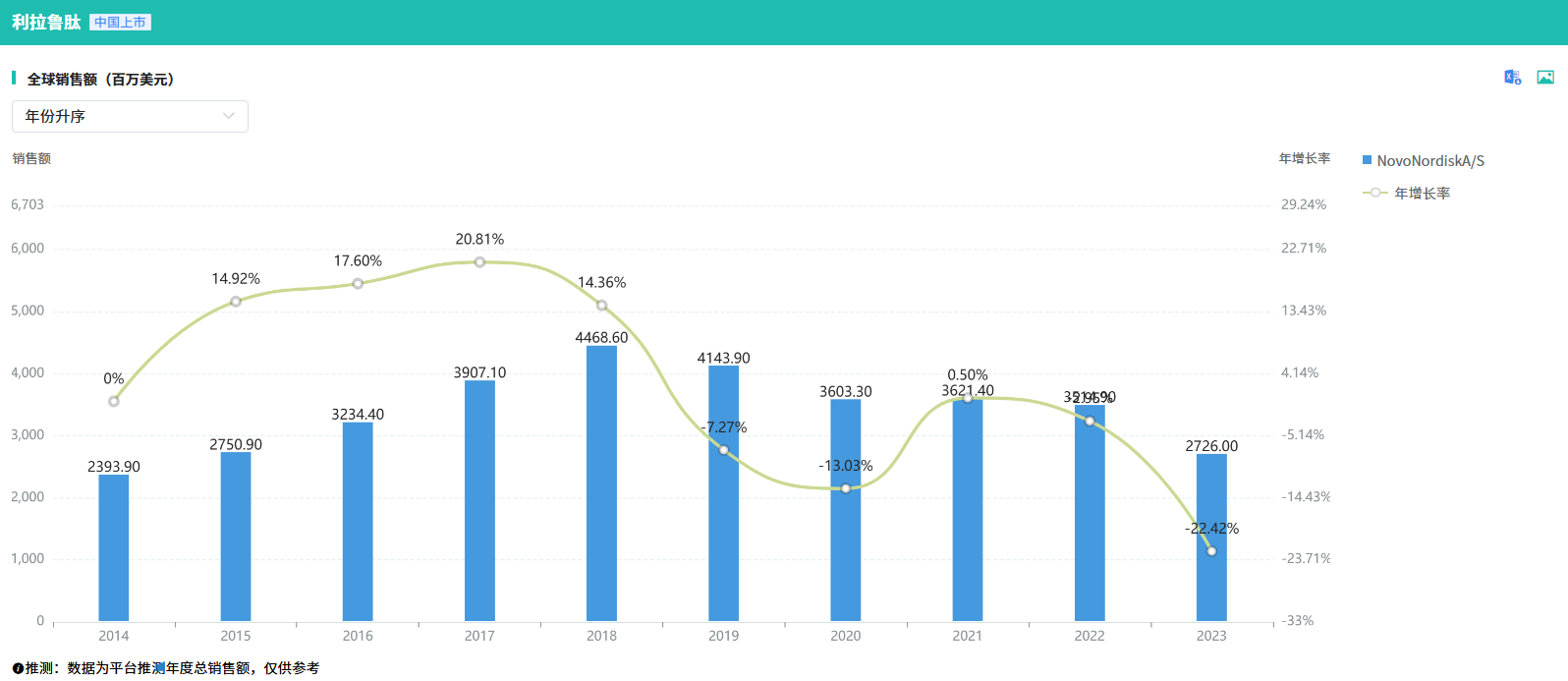
2023年利拉鲁肽的终端市场规模达到了59亿美元,其中美国市场占据了30亿美元,而中国市场规模则为2亿美元。在全球市场范围内,利拉鲁肽在2023年的销售额超27亿美元。据企业最新发布的新闻稿透露,该产品已获得FDA的首个利拉鲁肽生物类似药(规格为18 mg/3 ml)批准。此外,值得注意的是,该产品已于今年10月中旬向CDE提交了上市申请并已获得受理。同时,东南亚、南美、中东等地区的上市申请也将相继进入申报流程。
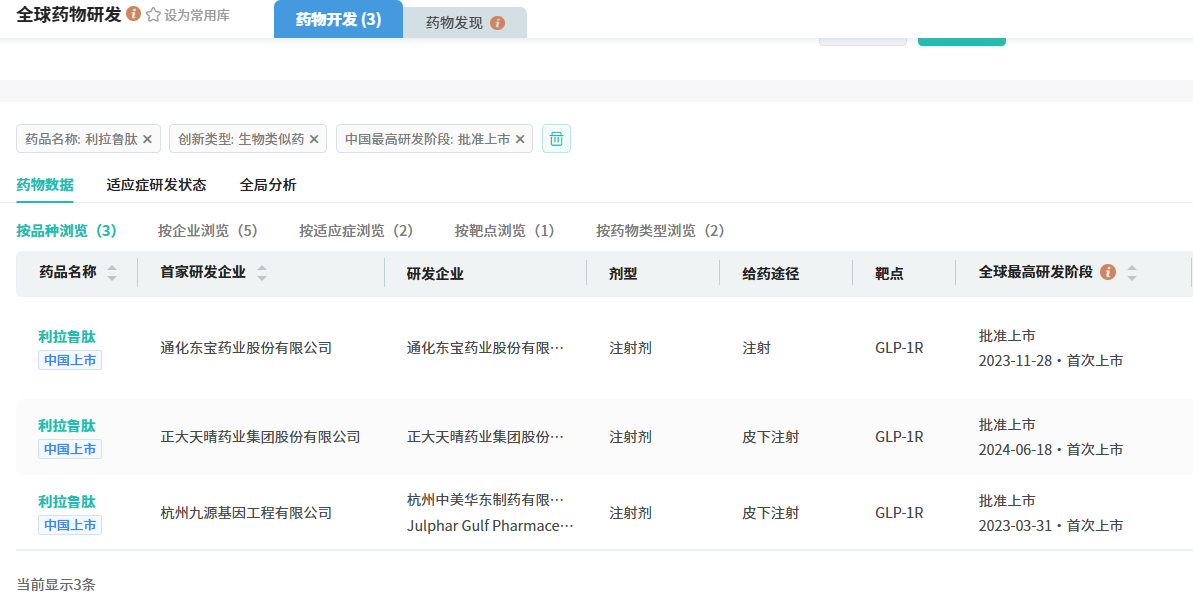
据摩熵医药数据库显示,国内已有3款利拉鲁肽生物类似药获批上市,分别来自杭州$九源基因(HK|02566)$、通化东宝和正大天晴。
$翰宇药业(SZ300199)$与Hikma Pharmaceuticals联合申报的利拉鲁肽注射液新药简略申请获得FDA批准,标志着该药物在全球市场的进一步拓展。作为国内外市场上备受关注的糖尿病治疗药物,利拉鲁肽的市场前景广阔。翰宇药业的此次成功,不仅为公司带来了新的增长点,也为全球2型糖尿病患者提供了更多的治疗选择。同时,随着国内多款利拉鲁肽生物类似药的获批上市,国内糖尿病治疗领域将迎来更加激烈的竞争和更多的创新机遇。
参考来源:
[1] 企业官方公告
[2] 摩熵医药(原药融云)数据库
<END>
本文作者可以追加内容哦 !

