$常山药业(SZ300255)$ 闲着无聊,老顽童尝试一下寻找常山药业1.1类创新药上市申请暂停原因哈!请注意是尝试!![得意 [得意]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot18.png)
![得意 [得意]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot18.png)
![得意 [得意]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot18.png) 一,评审中心2024年1月1日~2025年1月1日一年间,上市申请正常评审暂停后,申请编号仍然留在正常评审目录的只有一家,其它的暂停之后都去了二个地方,要么是补充材料目录,要么在评审中心在审目录消失不见了,消失不见即是这一趟白走了。
一,评审中心2024年1月1日~2025年1月1日一年间,上市申请正常评审暂停后,申请编号仍然留在正常评审目录的只有一家,其它的暂停之后都去了二个地方,要么是补充材料目录,要么在评审中心在审目录消失不见了,消失不见即是这一趟白走了。![得意 [得意]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot18.png) 暂停之后留在补充材料目录的60个工作日之后,再次回到正常评审3~5日后又离开了评审中心,这个很正常哈!补充材料也叫再申请评审,通过率0.1%以下,二次驳回速度很快的,只有60个工作日的时效!
暂停之后留在补充材料目录的60个工作日之后,再次回到正常评审3~5日后又离开了评审中心,这个很正常哈!补充材料也叫再申请评审,通过率0.1%以下,二次驳回速度很快的,只有60个工作日的时效!![俏皮 [俏皮]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot8.png)
![俏皮 [俏皮]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot8.png)
![俏皮 [俏皮]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot8.png) 回到艾本那肽上市申请暂停这个话题!一,艾本那肽评审暂停补充资料但又不去补充材料目录,说明艾本补充的资料与正常评审的内容无关,而且评审己到了暂停也不会驳回的程序了。
回到艾本那肽上市申请暂停这个话题!一,艾本那肽评审暂停补充资料但又不去补充材料目录,说明艾本补充的资料与正常评审的内容无关,而且评审己到了暂停也不会驳回的程序了。![得意 [得意]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot18.png) 二,评审中心评审路线图中在哪个环节暂停不会进入补充材料目录呢?相信持续关注艾本那肽评审的人很容易找到答案吧?
二,评审中心评审路线图中在哪个环节暂停不会进入补充材料目录呢?相信持续关注艾本那肽评审的人很容易找到答案吧?![俏皮 [俏皮]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot8.png) 三,评审中心评审暂停补充资料也不会进入补充材料目录的专业评审只有二个,而且必须是评审己过了综合评审这个节点(这个在帖子最后附上评审中心路线图中介绍)。
三,评审中心评审暂停补充资料也不会进入补充材料目录的专业评审只有二个,而且必须是评审己过了综合评审这个节点(这个在帖子最后附上评审中心路线图中介绍)。![得意 [得意]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot18.png) 四,专业评审过综合评审后,类仿仿制药进入注册行政审批,之后是制证。原研药艾本那肽因为2024年3月1日评审中心己公示过一次艾本那肽250ml/瓶原料药己完成原料注册备案登记,也即艾本那肽己完成过一次行政审批专业评审了,而且注册上市只有一次行政审批,所以艾本那肽暂停也不会驳回,因为行政审批己于2024年3月1日之前己完成专业评审。
四,专业评审过综合评审后,类仿仿制药进入注册行政审批,之后是制证。原研药艾本那肽因为2024年3月1日评审中心己公示过一次艾本那肽250ml/瓶原料药己完成原料注册备案登记,也即艾本那肽己完成过一次行政审批专业评审了,而且注册上市只有一次行政审批,所以艾本那肽暂停也不会驳回,因为行政审批己于2024年3月1日之前己完成专业评审。![得意 [得意]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot18.png) 五,原研药完成综合评审之后的行政审批环节2020年新规之后改成了综合评价,而且综合评价是沟通交流的方式进行,综合评价也即制定新的国家标准,目前己上市的国家标准明显己不适合艾本那肽了。艾本那肽需补充的资料包括,一,新国标的药品上市工商登记。二,新国标的药品上市销售许可证。三,新国标的药品生产许可证。这三个资料国家药监局给不了,必须回到省药监局才可办理,因为这三个资料只能在省药监局办理完成后再上报给国家药监会批准,也即制证环节必须回到省药监局办理,所以评审中心必须暂停评审,等待省药局的资料补充后再恢复!省药监局和国家药监局是上下级关系,程序上必须一停一恢复,不然会乱套的!
五,原研药完成综合评审之后的行政审批环节2020年新规之后改成了综合评价,而且综合评价是沟通交流的方式进行,综合评价也即制定新的国家标准,目前己上市的国家标准明显己不适合艾本那肽了。艾本那肽需补充的资料包括,一,新国标的药品上市工商登记。二,新国标的药品上市销售许可证。三,新国标的药品生产许可证。这三个资料国家药监局给不了,必须回到省药监局才可办理,因为这三个资料只能在省药监局办理完成后再上报给国家药监会批准,也即制证环节必须回到省药监局办理,所以评审中心必须暂停评审,等待省药局的资料补充后再恢复!省药监局和国家药监局是上下级关系,程序上必须一停一恢复,不然会乱套的!![得意 [得意]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot18.png)
![得意 [得意]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot18.png)
![得意 [得意]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot18.png) 六,艾本那肽上市申请最后一环节,制证。可以猜到河北省药监局正在办理之中,这个董秘不会回答你,因为一旦回答你,60万元就会不见了,还会连累上市公司一起受罚!所以才会有昨天河北电视台的党报软文推介,常山药业未来仍三个国际一流新药研发生产基地,肝素,抗糖尿病,抗肿瘤病,而且用字十分讲究,用了罕见的"抗"字,不仅仅是治疗,而抗,抗即是对抗的意思,除了治疗还可以预防,说明至少河北药监局己认为常山药业的艾本那肽和晚期抗肿瘤药的国际一流水平。
六,艾本那肽上市申请最后一环节,制证。可以猜到河北省药监局正在办理之中,这个董秘不会回答你,因为一旦回答你,60万元就会不见了,还会连累上市公司一起受罚!所以才会有昨天河北电视台的党报软文推介,常山药业未来仍三个国际一流新药研发生产基地,肝素,抗糖尿病,抗肿瘤病,而且用字十分讲究,用了罕见的"抗"字,不仅仅是治疗,而抗,抗即是对抗的意思,除了治疗还可以预防,说明至少河北药监局己认为常山药业的艾本那肽和晚期抗肿瘤药的国际一流水平。![俏皮 [俏皮]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot8.png)
![俏皮 [俏皮]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot8.png)
![俏皮 [俏皮]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot8.png) 老顽童个人认知分享,不喜勿喷!附下图列表评审中心路线图以供参考!
老顽童个人认知分享,不喜勿喷!附下图列表评审中心路线图以供参考!
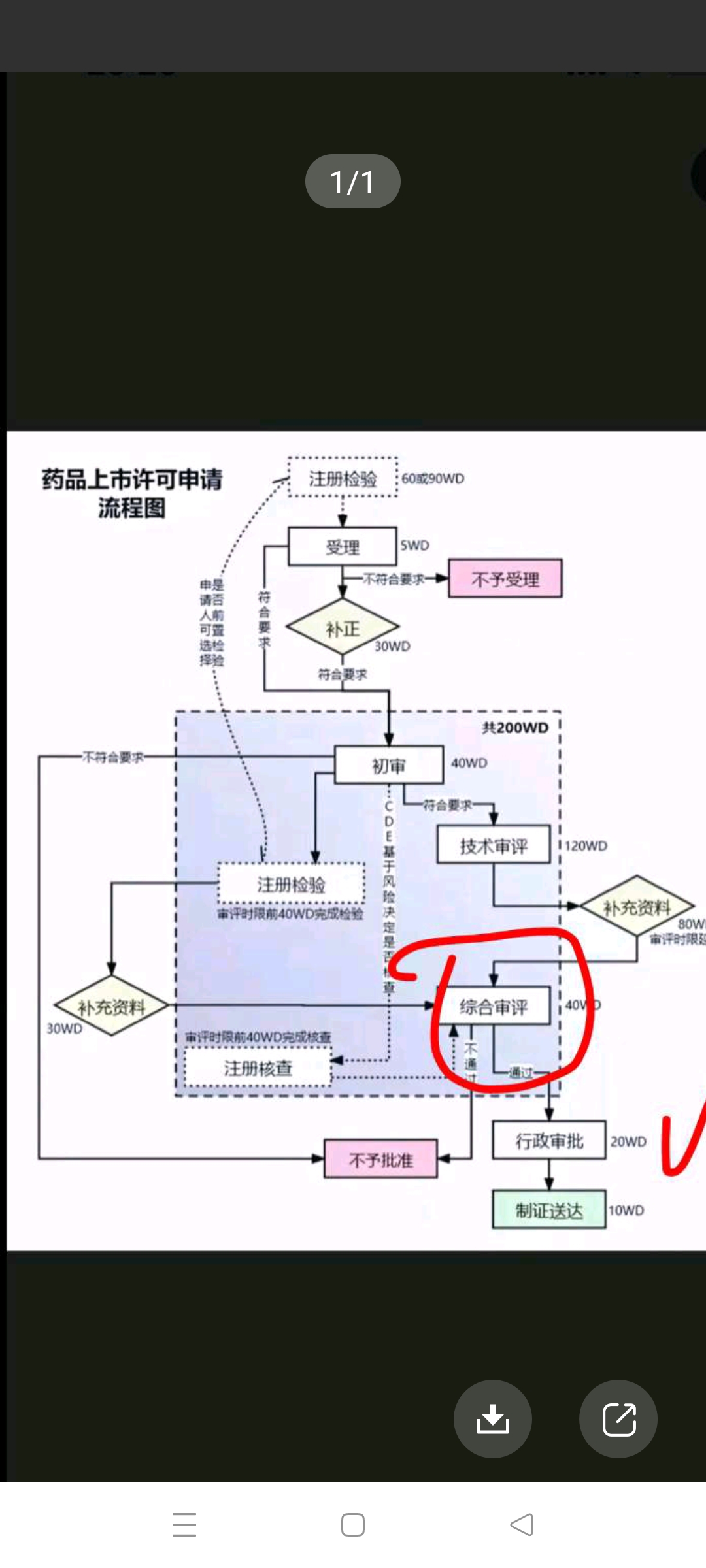
上图中综合评审有三个箭头指向,一个是不批准,一个是补充材料,一个是行政审批。这也是前几天老顽童认为艾本那肽上市申请时钟己过了综合评审的原因。在综合评审以及之前的程序中都有进入补充材料目录,所以暂停之中的艾本那肽需补充的资料只剩省药监局的制证以及制证后的提交国家药监会批准上市的程序,才能暂停仍然留在正常评审目录之中!严谨分析能力是股市不倒之前提,望后生可畏,长江后浪扑前浪,让前浪留在沙滩上!![大笑 [大笑]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot2.png)
![大笑 [大笑]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot2.png)
![大笑 [大笑]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot2.png)
![大笑 [大笑]](http://gbfek.dfcfw.com/face/emot_default_28x28/emot2.png)
本文作者可以追加内容哦 !


