3月21日,药物临床试验登记与信息公示平台显示,博瑞医药启动了BGM0504对比替尔泊肽的减重II期临床试验。 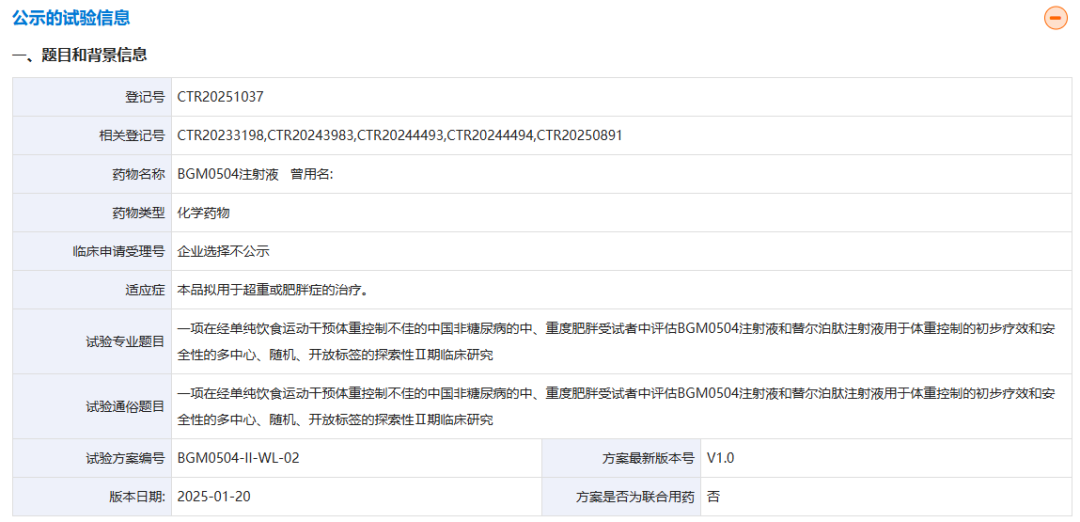 该研究是一项为期26周的多中心、随机、开放标签临床试验(n=90),旨在评估BGM0504(25mg,每周1次,皮下注射)对比替尔泊肽(15mg,每周1次,皮下注射)在经单纯饮食运动干预体重控制不佳的中国非糖尿病的中、重度肥胖(BMI>35.0kg/m2)成人受试者中的有效性和安全性。研究的主要终点是26周患者体重较基线的相对变化百分比。 BGM0504是博瑞医药自主研发的GLP-1R/GIPR激动剂,于2023年1月进入临床开发阶段(定义为启动I期临床)。目前,BGM0504已完成一项降糖II期研究和一项减重II期研究,相关结果也已公布。 在降糖II期研究中,初诊或初治2型糖尿病患者接受每周1次的BGM0504治疗后,5/10/15mg剂量组患者的HbA1c水平均显著降低。 具体展开来看,治疗第4周时,5/10/15mg BGM0504组和司美格鲁肽组患者的HbA1c水平较基线平均降幅(扣除安慰剂)分别为-1.32%、-1.48%、-2.16%和-1.03%。 治疗第12周时,5/10/15mg BGM0504组和司美格鲁肽组患者的HbA1c水平较基线平均降幅(扣除安慰剂)分别为-1.99%、-2.21%、-2.76%和-1.71%;控糖达标率(给药治疗后HbA1c<7.0%的患者比例)分别为76.9%、81.8%、91.7%和75%,其中中高剂量组中分别有27.3%和50%的受试者达到了糖化正常水平(HbA1c<5.7%),远高于司美格鲁肽组(12.5%)。
该研究是一项为期26周的多中心、随机、开放标签临床试验(n=90),旨在评估BGM0504(25mg,每周1次,皮下注射)对比替尔泊肽(15mg,每周1次,皮下注射)在经单纯饮食运动干预体重控制不佳的中国非糖尿病的中、重度肥胖(BMI>35.0kg/m2)成人受试者中的有效性和安全性。研究的主要终点是26周患者体重较基线的相对变化百分比。 BGM0504是博瑞医药自主研发的GLP-1R/GIPR激动剂,于2023年1月进入临床开发阶段(定义为启动I期临床)。目前,BGM0504已完成一项降糖II期研究和一项减重II期研究,相关结果也已公布。 在降糖II期研究中,初诊或初治2型糖尿病患者接受每周1次的BGM0504治疗后,5/10/15mg剂量组患者的HbA1c水平均显著降低。 具体展开来看,治疗第4周时,5/10/15mg BGM0504组和司美格鲁肽组患者的HbA1c水平较基线平均降幅(扣除安慰剂)分别为-1.32%、-1.48%、-2.16%和-1.03%。 治疗第12周时,5/10/15mg BGM0504组和司美格鲁肽组患者的HbA1c水平较基线平均降幅(扣除安慰剂)分别为-1.99%、-2.21%、-2.76%和-1.71%;控糖达标率(给药治疗后HbA1c<7.0%的患者比例)分别为76.9%、81.8%、91.7%和75%,其中中高剂量组中分别有27.3%和50%的受试者达到了糖化正常水平(HbA1c<5.7%),远高于司美格鲁肽组(12.5%)。 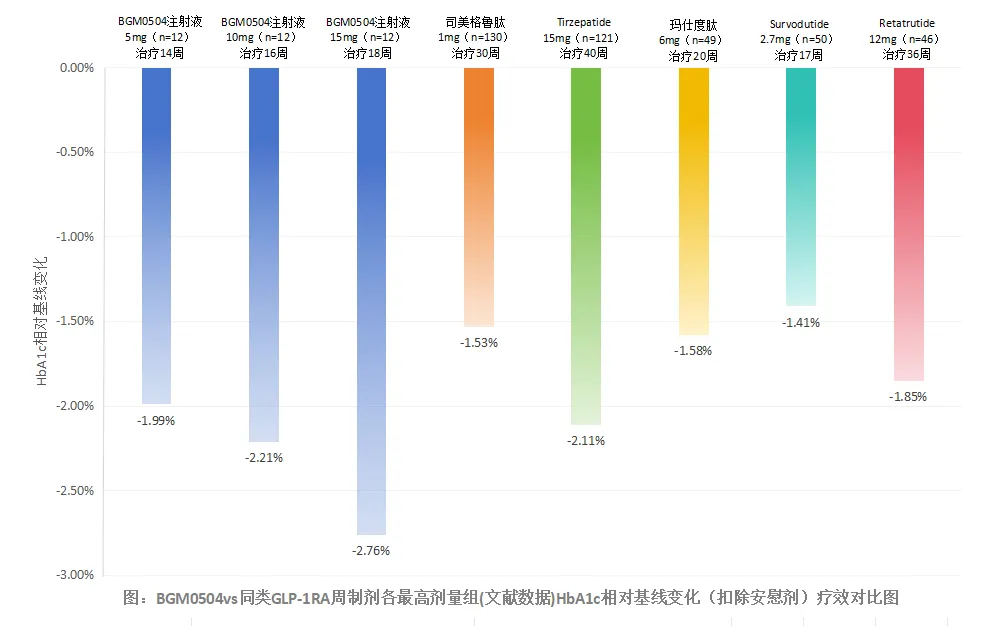 BGM0504在其它指标上亦有显著优势,详见:博瑞医药BGM0504 II期降糖头对头数据公布,优于司美格鲁肽和替尔泊肽历史数据。 在减重II期研究中,不伴2型糖尿病的超重或肥胖受试者接受每周1次的BGM0504治疗后,5/10/15mg剂量组患者的体重均显著减轻。 具体展开来看,治疗第4周时,5/10/15mg BGM0504组受试者的体重较基线平均降幅(扣除安慰剂)分别为-5.20%、-7.00%和-9.50%;治疗第12周时,5/10/15mg BGM0504组受试者的体重较基线平均降幅(扣除安慰剂)分别为-8.40%、-12.00%和-13.80%;治疗第24周时,5/10/15mg BGM0504组受试者的体重较基线平均降幅(扣除安慰剂)分别为-10.80%、-16.20%和-18.50%。 BGM0504在其它指标上亦有显著优势,详见:24周减重18.5%!博瑞医药GLP-1R/GIPR激动剂减重II期研究成功。 基于II期研究数据,博瑞医药已启动3项III期临床试验以进一步评估BGM0504的降糖和减重疗效,包括:
BGM0504在其它指标上亦有显著优势,详见:博瑞医药BGM0504 II期降糖头对头数据公布,优于司美格鲁肽和替尔泊肽历史数据。 在减重II期研究中,不伴2型糖尿病的超重或肥胖受试者接受每周1次的BGM0504治疗后,5/10/15mg剂量组患者的体重均显著减轻。 具体展开来看,治疗第4周时,5/10/15mg BGM0504组受试者的体重较基线平均降幅(扣除安慰剂)分别为-5.20%、-7.00%和-9.50%;治疗第12周时,5/10/15mg BGM0504组受试者的体重较基线平均降幅(扣除安慰剂)分别为-8.40%、-12.00%和-13.80%;治疗第24周时,5/10/15mg BGM0504组受试者的体重较基线平均降幅(扣除安慰剂)分别为-10.80%、-16.20%和-18.50%。 BGM0504在其它指标上亦有显著优势,详见:24周减重18.5%!博瑞医药GLP-1R/GIPR激动剂减重II期研究成功。 基于II期研究数据,博瑞医药已启动3项III期临床试验以进一步评估BGM0504的降糖和减重疗效,包括:
 该研究是一项为期26周的多中心、随机、开放标签临床试验(n=90),旨在评估BGM0504(25mg,每周1次,皮下注射)对比替尔泊肽(15mg,每周1次,皮下注射)在经单纯饮食运动干预体重控制不佳的中国非糖尿病的中、重度肥胖(BMI>35.0kg/m2)成人受试者中的有效性和安全性。研究的主要终点是26周患者体重较基线的相对变化百分比。 BGM0504是博瑞医药自主研发的GLP-1R/GIPR激动剂,于2023年1月进入临床开发阶段(定义为启动I期临床)。目前,BGM0504已完成一项降糖II期研究和一项减重II期研究,相关结果也已公布。 在降糖II期研究中,初诊或初治2型糖尿病患者接受每周1次的BGM0504治疗后,5/10/15mg剂量组患者的HbA1c水平均显著降低。 具体展开来看,治疗第4周时,5/10/15mg BGM0504组和司美格鲁肽组患者的HbA1c水平较基线平均降幅(扣除安慰剂)分别为-1.32%、-1.48%、-2.16%和-1.03%。 治疗第12周时,5/10/15mg BGM0504组和司美格鲁肽组患者的HbA1c水平较基线平均降幅(扣除安慰剂)分别为-1.99%、-2.21%、-2.76%和-1.71%;控糖达标率(给药治疗后HbA1c<7.0%的患者比例)分别为76.9%、81.8%、91.7%和75%,其中中高剂量组中分别有27.3%和50%的受试者达到了糖化正常水平(HbA1c<5.7%),远高于司美格鲁肽组(12.5%)。
该研究是一项为期26周的多中心、随机、开放标签临床试验(n=90),旨在评估BGM0504(25mg,每周1次,皮下注射)对比替尔泊肽(15mg,每周1次,皮下注射)在经单纯饮食运动干预体重控制不佳的中国非糖尿病的中、重度肥胖(BMI>35.0kg/m2)成人受试者中的有效性和安全性。研究的主要终点是26周患者体重较基线的相对变化百分比。 BGM0504是博瑞医药自主研发的GLP-1R/GIPR激动剂,于2023年1月进入临床开发阶段(定义为启动I期临床)。目前,BGM0504已完成一项降糖II期研究和一项减重II期研究,相关结果也已公布。 在降糖II期研究中,初诊或初治2型糖尿病患者接受每周1次的BGM0504治疗后,5/10/15mg剂量组患者的HbA1c水平均显著降低。 具体展开来看,治疗第4周时,5/10/15mg BGM0504组和司美格鲁肽组患者的HbA1c水平较基线平均降幅(扣除安慰剂)分别为-1.32%、-1.48%、-2.16%和-1.03%。 治疗第12周时,5/10/15mg BGM0504组和司美格鲁肽组患者的HbA1c水平较基线平均降幅(扣除安慰剂)分别为-1.99%、-2.21%、-2.76%和-1.71%;控糖达标率(给药治疗后HbA1c<7.0%的患者比例)分别为76.9%、81.8%、91.7%和75%,其中中高剂量组中分别有27.3%和50%的受试者达到了糖化正常水平(HbA1c<5.7%),远高于司美格鲁肽组(12.5%)。  BGM0504在其它指标上亦有显著优势,详见:博瑞医药BGM0504 II期降糖头对头数据公布,优于司美格鲁肽和替尔泊肽历史数据。 在减重II期研究中,不伴2型糖尿病的超重或肥胖受试者接受每周1次的BGM0504治疗后,5/10/15mg剂量组患者的体重均显著减轻。 具体展开来看,治疗第4周时,5/10/15mg BGM0504组受试者的体重较基线平均降幅(扣除安慰剂)分别为-5.20%、-7.00%和-9.50%;治疗第12周时,5/10/15mg BGM0504组受试者的体重较基线平均降幅(扣除安慰剂)分别为-8.40%、-12.00%和-13.80%;治疗第24周时,5/10/15mg BGM0504组受试者的体重较基线平均降幅(扣除安慰剂)分别为-10.80%、-16.20%和-18.50%。 BGM0504在其它指标上亦有显著优势,详见:24周减重18.5%!博瑞医药GLP-1R/GIPR激动剂减重II期研究成功。 基于II期研究数据,博瑞医药已启动3项III期临床试验以进一步评估BGM0504的降糖和减重疗效,包括:
BGM0504在其它指标上亦有显著优势,详见:博瑞医药BGM0504 II期降糖头对头数据公布,优于司美格鲁肽和替尔泊肽历史数据。 在减重II期研究中,不伴2型糖尿病的超重或肥胖受试者接受每周1次的BGM0504治疗后,5/10/15mg剂量组患者的体重均显著减轻。 具体展开来看,治疗第4周时,5/10/15mg BGM0504组受试者的体重较基线平均降幅(扣除安慰剂)分别为-5.20%、-7.00%和-9.50%;治疗第12周时,5/10/15mg BGM0504组受试者的体重较基线平均降幅(扣除安慰剂)分别为-8.40%、-12.00%和-13.80%;治疗第24周时,5/10/15mg BGM0504组受试者的体重较基线平均降幅(扣除安慰剂)分别为-10.80%、-16.20%和-18.50%。 BGM0504在其它指标上亦有显著优势,详见:24周减重18.5%!博瑞医药GLP-1R/GIPR激动剂减重II期研究成功。 基于II期研究数据,博瑞医药已启动3项III期临床试验以进一步评估BGM0504的降糖和减重疗效,包括:
BGM0504-III-WL(n=620):在中国非糖尿病的超重或肥胖成人患者中评估 BGM0504对比安慰剂的减重疗效和安全性;
BGM0504-III-T2DM-01(n=207):在饮食和运动血糖控制不佳的初治中国2型糖尿病成人患者中评估BGM0504对比安慰剂的降糖疗效和安全性;
BGM0504-III-T2DM-02(n=537):在二甲双胍单药或二甲双胍联合磺脲类药物治疗血糖控制不佳的中国2型糖尿病成人患者中评估BGM0504对比司美格鲁肽(1mg)的降糖疗效和安全性。
追加内容
本文作者可以追加内容哦 !


