 Gepotidacin是一种靶向拓扑异构酶II(Top II)的first in class新型口服抗生素,其结构属于三氮杂苊烯类,不同于现有的喹诺酮类抗生素。相比于喹诺酮类抗生素(单一抑制Top II或Top IV),Gepotidacin具有全新的作用机制,可选择性且均衡抑制细菌DNA回旋酶(Top II的一种)和Top IV,从而抑制细菌DNA复制。由于Gepotidacin对Top II和Top IV为均衡抑制,因此,当这两种酶均发生突变时才会显著影响细菌对Gepotidacin的敏感性。
Gepotidacin是一种靶向拓扑异构酶II(Top II)的first in class新型口服抗生素,其结构属于三氮杂苊烯类,不同于现有的喹诺酮类抗生素。相比于喹诺酮类抗生素(单一抑制Top II或Top IV),Gepotidacin具有全新的作用机制,可选择性且均衡抑制细菌DNA回旋酶(Top II的一种)和Top IV,从而抑制细菌DNA复制。由于Gepotidacin对Top II和Top IV为均衡抑制,因此,当这两种酶均发生突变时才会显著影响细菌对Gepotidacin的敏感性。  Gepotidacin结构 FDA此次批准主要是基于两项关键性III期研究(EAGLE-2和EAGLE-3)的积极数据。EAGLE-2研究和EAGLE-3研究均为全球性、随机、双盲、非劣效性(界限值为10%)临床试验(n=3136),评估了Gepotidacin(1500mg,每日2次)对比呋喃妥因(100mg,每日2次)治疗uUTI的有效性和安全性。研究的主要终点为第10-13天治愈检验期(TOC)访视时产生治疗应答(包括临床应答和微生物学应答)的患者数量。 在EAGLE-2研究中,Gepotidacin组和呋喃妥因组分别有50.6%(162/320)和47.0%(135/287)的患者实现“治疗成功”;在EAGLE-3研究中,Gepotidacin组和呋喃妥因组分别有58.5%(162/277)和43.6%(115/264)的患者实现“治疗成功”。此外,在治疗失败风险更高的关键亚组中,Gepotidacin也表现出一致的非劣效于呋喃妥因的疗效,包括大肠杆菌病原体对其他抗生素耐药的患者、有复发史的患者和50岁以上的患者。
Gepotidacin结构 FDA此次批准主要是基于两项关键性III期研究(EAGLE-2和EAGLE-3)的积极数据。EAGLE-2研究和EAGLE-3研究均为全球性、随机、双盲、非劣效性(界限值为10%)临床试验(n=3136),评估了Gepotidacin(1500mg,每日2次)对比呋喃妥因(100mg,每日2次)治疗uUTI的有效性和安全性。研究的主要终点为第10-13天治愈检验期(TOC)访视时产生治疗应答(包括临床应答和微生物学应答)的患者数量。 在EAGLE-2研究中,Gepotidacin组和呋喃妥因组分别有50.6%(162/320)和47.0%(135/287)的患者实现“治疗成功”;在EAGLE-3研究中,Gepotidacin组和呋喃妥因组分别有58.5%(162/277)和43.6%(115/264)的患者实现“治疗成功”。此外,在治疗失败风险更高的关键亚组中,Gepotidacin也表现出一致的非劣效于呋喃妥因的疗效,包括大肠杆菌病原体对其他抗生素耐药的患者、有复发史的患者和50岁以上的患者。 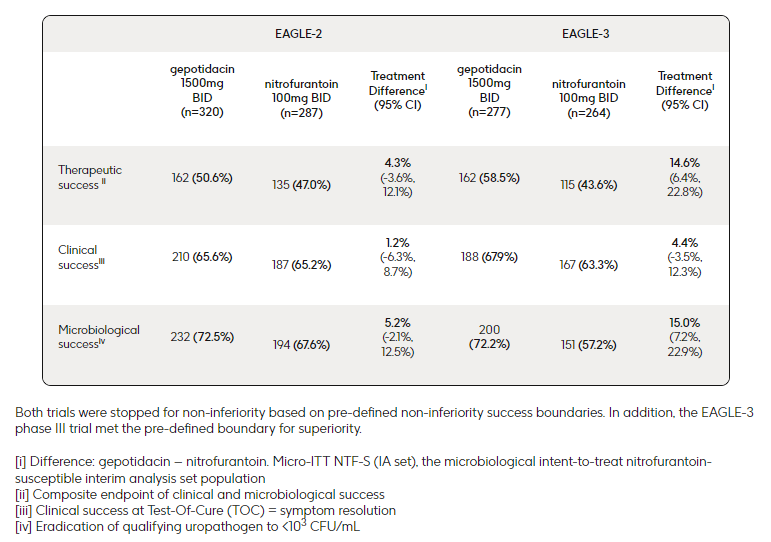 EAGLE-2研究和EAGLE-3研究主要结果 (来源:GSK官网) Gepotidacin组最常报告的不良事件(AE)是胃肠道反应,其中腹泻(16%)和恶心(9%)较为常见。不过这些AE的严重程度大多数为轻度(1级,69%)和中度(2级,28%)。 非复杂性尿路感染 (uUTI) 是最常见的门诊感染,超过一半的女性在其一生中会患上一次uUTI,其中30%的患者为复发性uUTI。据估计,美国每年约有1600万例uUTI女性患者。
EAGLE-2研究和EAGLE-3研究主要结果 (来源:GSK官网) Gepotidacin组最常报告的不良事件(AE)是胃肠道反应,其中腹泻(16%)和恶心(9%)较为常见。不过这些AE的严重程度大多数为轻度(1级,69%)和中度(2级,28%)。 非复杂性尿路感染 (uUTI) 是最常见的门诊感染,超过一半的女性在其一生中会患上一次uUTI,其中30%的患者为复发性uUTI。据估计,美国每年约有1600万例uUTI女性患者。
Copyright 2025 PHARMCUBE. All Rights Reserved.

本文作者可以追加内容哦 !


