3月28日,诺华宣布美国FDA已批准 Pluvicto(lutetium Lu 177 vipivotide tetraxetan,镥[177Lu] 特昔维匹肽)用于前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)患者,这些患者已接受雄激素受体通路抑制剂(ARPI)治疗且被认为适合延迟化疗。

Pluvicto是首款靶向PSMA的核药,能够精准辐射前列腺癌,具备替代全身放疗的潜力,2024年(上市第三年)以13.92亿美元销售额解锁核药赛道首个"重磅炸弹"成就。此次Pluvicto的新适应症获批,使适用患者群体增加约两倍。
此次获批基于PSMAfore研究的积极结果。该研究是一项多中心、随机、开放标签临床试验(n=469),评估了PSMA阳性mCRPC患者由接受ARPI(阿比特龙或恩扎卢胺)治疗转换至接受Pluvicto治疗的疗效和安全性。研究的主要终点是影像学无进展生存期(rPFS)。
结果显示,Pluvicto 将影像学进展或死亡的风险降低了 59%(HR=0.41;95% CI:0.29、0.56;p<0.0001)。在更新的探索性分析中,Pluvicto 的中位rPFS较对照组增加了一倍多(11.6 vs 5.6 个月)。
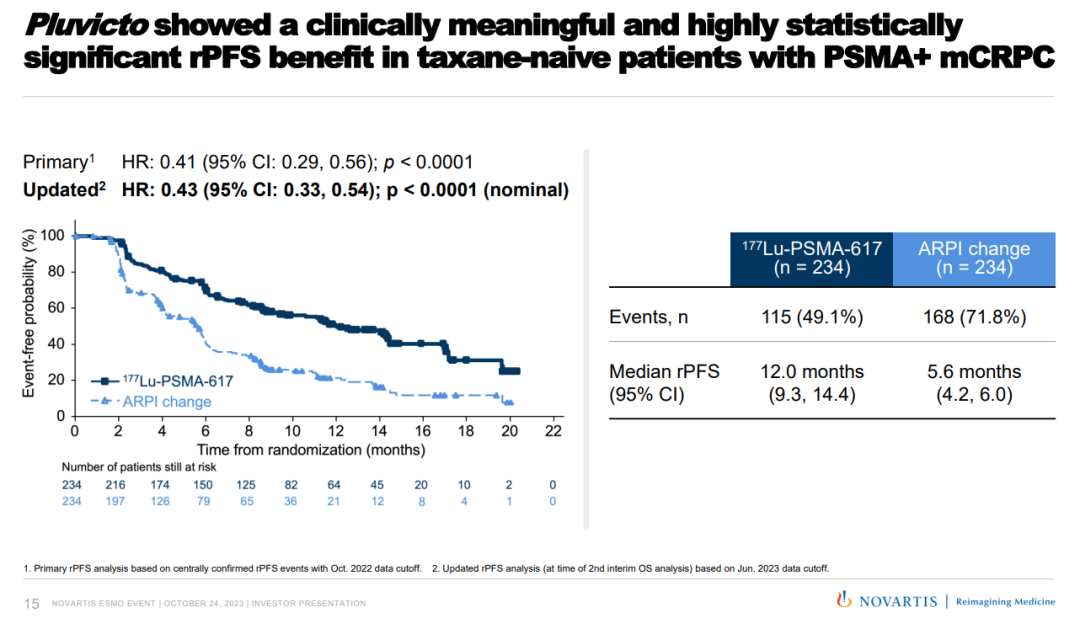 2023年公布的rPFS数据(来源:ESMO 2023) 安全性方面,经过额外8个月的随访,Pluvicto的安全性也与2023年提出的结果保持一致。
2023年公布的rPFS数据(来源:ESMO 2023) 安全性方面,经过额外8个月的随访,Pluvicto的安全性也与2023年提出的结果保持一致。 纪念斯隆凯特琳癌症中心泌尿肿瘤前列腺癌科主任、美国研究首席研究员 Michael Morris 医学博士表示:“Pluvicto 的早期适应症可能彻底改变 mCRPC的治疗范式。与二线 ARPI 相比,它提供了一种更有效的靶向疗法以延缓疾病进展。此次批准是重要里程碑,为一线 ARPI 进展且未接受化疗的 mCRPC 患者开启了更优治疗选择。”
Copyright 2025 PHARMCUBE. All Rights Reserved.
欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。
免责申明:本微信文章中的信息仅供一般参考之用,不可直接作为决策内容,医药魔方不对任何主体因使用本文内容而导致的任何损失承担责任。本文作者可以追加内容哦 !


