概 要
这项队列研究使用了贝伐珠单抗之前7项随机3期临床试验(ICON7、GOG-0218、BOOST、GOG-0213、OCEANS、AURERIA和MITO16B)的已发表数据,时间从2023年1月10日至2023年1月31日。通过对ICON7试验的2项辅助分析(包括患者个体数据和肿瘤基因表达谱),产生了由745个病例组成的ICON7-A队列。对其他研究中已发表的Kaplan-Meier曲线进行了图形分析。在巢癌中,贝伐珠单抗可在开始治疗后约1年内减少病情进展,但在浆液性亚型中,无论HRD状态如何,停用贝伐珠单抗可能会增加随后的病情进展。结果表明,在一线治疗中,贝伐珠单抗可能对预后较短的患者更有益,因为这些患者不太可能出现结果的反弹。
介 绍
在妇科癌症中,巢癌的预后最差。大多数病例确诊时已是晚期并伴有腹膜播散,需要结合手术和药物治疗。标准的一线化疗是紫杉醇和卡铂的组合,但在过去十年中,抗血管内皮生长因子(VEGF)-A抗体贝伐珠单抗已与化疗相结合,并用于后续的维持治疗。然而,占巢癌大多数的高级别浆液性癌常常伴有DNA同源重组缺陷(HRD),由于HRD与对铂和多(腺苷二磷酸核糖)聚合酶(PARP)抑制剂的敏感性有关,因此最近在临床实践中提出了基于HRD状态的个体化治疗。因此,详细研究贝伐珠单抗的治疗效果与巢癌HRD状态之间的关联变得更加重要。
ICON7试验是一项随机3期临床试验,1528名新确诊巢癌妇女接受了标准化疗或贝伐珠单抗联合治疗,在该试验中,贝伐珠单抗的剂量为7.5mg/m2,共治疗18个周期(12个月),降低了病情进展的风险,危险比为0.81(95%CI,0.70-0.94)。在GOG-0218研究中,贝伐珠单抗的用药剂量为15mg/m2,共22个周期(15个月),可降低进展风险,危险比为0.72(95%CI,0.63-0.82)。然而,由于对比组之间的进展风险差异随着时间的推移而显著变化,因此比例风险假设是不恰当的。尽管如此,以往研究贝伐珠单抗使用情况的报告(包括系统性综述)仍然应用了Cox比例风险回归模型。当该假设无效时,应采用可调整的方法对其进行评估,如受限平均生存时间(RMST)分析。
已发表研究中显示的Kaplan-Meier(KM)生存曲线可被视为易于获取、信息量大且有用的研究资料。我们中的一些人曾分析过ICON7、GOG-0218和BOOST试验的KM曲线,并报告了治疗组之间每15个月相对进展风险的变化。近年来,一些基于图像对已发表的KM曲线进行更详细分析并重建原始数据的方法得到了报道。
在此,我们分析了来自ICON7试验(ICON7-A队列)2项辅助分析的临床和基因表达数据,以及所有已发表的贝伐珠单抗治疗一线和复发性巢癌的3期临床试验的KM曲线图像。然后,我们分析了贝伐珠单抗治疗的进展风险。研究结果可为优化贝伐珠单抗在巢癌治疗中的应用提供重要启示。
方 法
一、ICON7-A组群
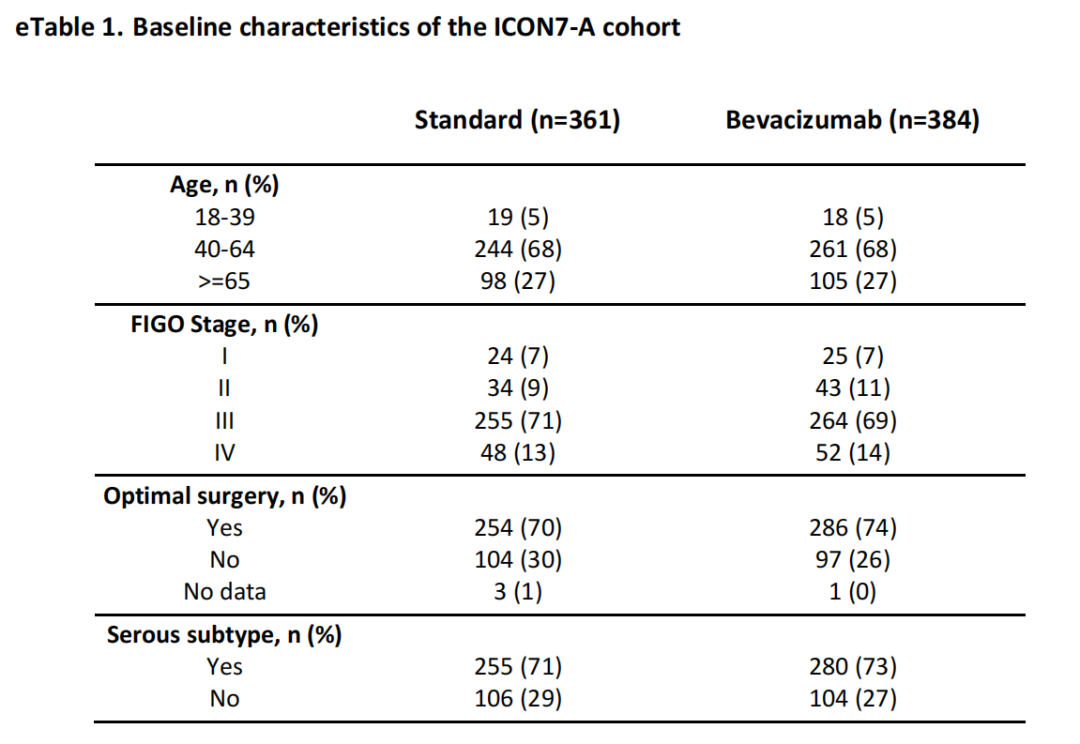
我们整合了Kommoss等人和Desbois等人对ICON7进行的两项独立辅助分析的数据集。我们从美国国家生物技术信息中心基因表达总库(GEO140082)获得了Kommoss等人保存的380例病例的微阵列基因表达谱(DASL,Illumina)和临床信息。根据Kommoss等人的研究,在参加德国ICON7(AGO-OVAR11试验)的533名患者中,423人有福尔马林固定石蜡包埋的肿瘤组织,391人有足够的RNA用于芯片分析。Desbois等人对ICON7试验中收集的370例福尔马林固定石蜡包埋肿瘤组织进行了总RNA测序。他们的原始测序数据和临床信息通过欧洲基因组-表型组档案库(登录号EGAS00001003487)获得,临床数据和测序数据匹配的365个病例被纳入本研究。获得上述数据的所有745例患者均被纳入分析,其基线特征总结见e表1。由于Desbois等人的报告对年龄数据进行了分类,因此我们采用了该分类方法,将65岁或以上的患者归入高年龄组。没有数据缺失。只有分层年龄,平均年龄未知。种族信息也不详。
e表1:ICON7-A组群的基线特征
二、进展风险曲线的计算
x轴和y轴的坐标以及每条KM曲线都是用1.53t版ImageJ软件从文章图表中提取的。曲线缺失部分由人工补全。曲线上各日点的存活率根据0和12个月或24个月时的x轴坐标以及存活率为0和100%时的y轴坐标计算得出。特定时间点的进展风险计算为该时间点后30天存活率曲线上的下降幅度。治疗组与对照组在每个时间点的进展风险之比计算为相对风险。当二者均为0时,则认为相对风险无法计算。每个时间点的病情进展风险和相对风险均以该时间点前后60天的简单移动平均值进行平滑处理,并对其变化进行分析。本研究中使用的先前发表的KM曲线的来源汇总于e表2。
表2:本研究中使用的已发表的Kaplan-Meler曲线的来源

三、统计分析
贝伐珠单抗治疗组和对照组的限制性平均存活时间使用4.1.2版survRM2进行比较。根据之前的报告,通过将调整后的卡普兰-梅耶估计器与反概率加权相结合,对RMST进行了调整。所有其他统计分析和结果可视化均使用Python3.8.8版本进行。生存分析包括Kaplan-Meier曲线、Cox比例风险假设检验和对数秩检验,均使用Python版本0.26.3的Lifelines进行。斯皮尔曼秩相关检验使用Python1.7.2版SciPy进行。机器学习分析使用Python的Scikit-learn1.0.1版进行。在双侧非配对测试中,显著性阈值设定为P<.05。
结 果
一、ICON7-A组群随时间变化的疾病进展风险
在ICON7-A队列(n=745)中(e表1),贝伐珠单抗组(n=384)与标准治疗组(对照组)(n=361)之间的无进展生存期(PFS)对比分析表明,比例风险模型无效(e图1A、B)。我们根据在随后30天内癌症进展的患者人数计算了特定时间点的进展风险,并将2组(贝伐珠单抗治疗组与对照组)之间的进展风险之比作为相对风险(e图1C、D)。用简单移动平均数平滑60天前和60天后的数值变化(e图1E)。在治疗早期,贝伐珠单抗组的病情进展风险低于对照组,但从6个月左右开始逐渐增加,在停止治疗的12个月左右达到与对照组相同的水平,此后又超过了对照组(e图1E)。限制性平均生存时间分析表明,在整个治疗期间,两组的PFS没有显著差异(RMST比值,1.07;95%CI,0.97-1.17;P=.16),但在贝伐珠单抗停药前贝伐珠单抗组明显更好(RMST比值,1.08;95%CI,1.05-1.11;P<.001),停药后贝伐珠单抗组明显更差(RMST比值,0.79;95%CI,0.69-0.90;P<.001)(图1)。此外,将分期、手术完成情况、年龄和组织学特征作为协变量进行调整后的RMST分析也显示出相似的结果(e图2)。以下将贝伐珠单抗停药后观察到的进展风险急剧增加称为反弹。
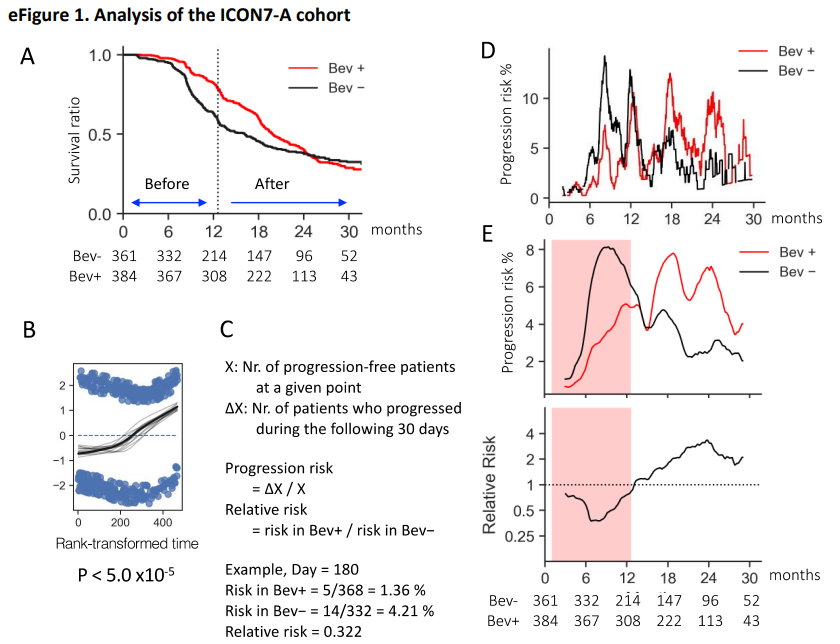
e图1:对ICON7-A组群的分析

e图2:在ICON7-A组群中使用RMST 和ARMST 比较PFS
二、按浆液性肿瘤和非浆液性肿瘤划分的ICON7-A分析
如e图2所示,与非浆液性亚型相比,浆液性亚型在贝伐珠单抗停药前的PFS较好,但停药后的PFS较差。我们按浆液性亚型(535人)和非浆液性亚型(210人)对患者进行了分层,并比较了贝伐珠单抗治疗组和对照组。在浆液性亚型中,我们观察到了与整个队列中相同的反弹效应(e图3A);贝伐珠单抗组和对照组之间的RSMT差异和病情进展风险在贝伐珠单抗停药前后发生了逆转(停药前:RMST比值为1.07;95%CI为1.04-1.11;P<.001;停药后:RMST比值为0.74;95%CI为0.62-0.87;P<.001)(图2A)。与此相反,在非脓毒症亚型中,虽然贝伐珠单抗组患者在贝伐珠单抗治疗期间的病情进展风险逐渐降低(e图3B),但停药后并未观察到明显的反弹(停药前:RMST比值为1.11;95%CI,1.05-1.18;P<.001;停药后:RMST比值为0.94;95%CI为0.78-1.15;P=.57)(图2B)。

e图3:按血清组织学和非血清组织学分层的ICON7-A组群分析


图1:ICON7-A组群的限制性平均存活时间(RMST)分析
三、将 ICON7-A 浆液性肿瘤分为HRD和非HRD分析
为了研究HRD状态是否与贝伐珠单抗治疗浆液型相关,我们根据ICON7-A队列中患者的基因表达谱预测了他们的HRD状态。我们发现,大约一半的患者(534例中的279例[52%])被分配到HRD组,HRD组的PFS优于非HRD组(P=.04)(e图4A)。分层分析表明,随着时间的推移,与贝伐珠单抗治疗相关的进展风险变化和反弹效应在HRD组都有类似的观察结果:HRD(治疗前:RMST比值为1.05;95%CI,1.02-1.09;P<.001;治疗后:RMST比值为0.79;95%CI,0.63-0.98;P=.04)(图3A;e图4B);非HRD(治疗前:RMST比值为1.08;95%CI,1.03-1.15;P<.001;治疗后:RMST比值为0.71;95%CI为0.56-0.90;P=.004)(图3B;e图4C),表明HRD状态似乎与贝伐珠单抗用药无关。

e图4:按HRD和非HRD亚型对ICON7-A浆液性队列进行分层分析
四、一线治疗病例的KM曲线分析
接下来,我们开发了一种方法,通过分析已发表的KM生存曲线图像来估算每个时间点的事件风险(e图5A、B)。我们将该方法应用于根据ICON7-A队列中单个患者数据构建的KM曲线,结果证实与上述方法非常相似(e图5C、D,e图1D、E)。利用这种方法,我们分析了贝伐珠单抗之前3期试验的KM曲线图像(e表2)。原始ICON7组群的结果与ICON7-A的结果相同(图4A;e图1E)。在高危患者(定义为国际妇产科联盟IV期疾病或国际妇产科联盟III期疾病且去势手术后残留疾病超过1.0厘米)和非高危患者中也观察到了类似的变化(e图6A)。GOG-0218试验的结果与ICON7试验的结果相似(图4B)。在GOG-0218试验的亚组分析中,根据同源重组修复相关基因的突变状态对病例进行了划分,结果没有明显差异(图6B)。在另一项GOG-0218亚组分析中,根据血液CA125水平的变化确定化疗敏感性状态进行分层,结果也类似(e图6C)。在BOOST试验中,随机分配患者接受贝伐珠单抗治疗15个月或30个月,从第15个月到第30个月,30个月组的病情进展风险略低于15个月组,但第30个月后的风险更高(e图4C)。

e图5:在ICON7-A组群中验证基于图像的Kaplan-Meler曲线分析法

图2:按浆液性和非浆液性组织学特征分层的ICON7-A队列限制性平均生存时间(RMST)分析

e图6:ICON7-A和GOG-0218研究中用于亚组分析的Kaplan-Meler曲线分析
五、复发病例的KM曲线分析
我们分析了复发性巢癌患者3期试验的KM曲线(e表2)。在GOG-0213试验中,贝伐珠单抗与紫杉醇加卡铂联合治疗铂敏感复发患者,然后进行维持治疗。在MITO16B中,贝伐珠单抗与铂类双联疗法联合用于治疗曾接受过贝伐珠单抗一线治疗的铂敏感复发患者。在所有这些研究中,贝伐珠单抗的用药时间并不预先确定,而是持续到疾病进展或出现不可接受的不良反应为止。与所有这些研究相同的是,贝伐珠单抗组与对照组相比,相对进展风险在治疗开始后不久最低,然后随着时间的推移逐渐升高,但没有持续超过1,表明没有反弹(图5)。

图3:按同源重组缺陷(HRD)和非HRD亚型分层的ICON7-A浆液性队列的限制性平均生存时间(RMST)分析
讨 论
我们在本研究中汇编的ICON7-A队列(n=745)的病例数约为原始ICON7队列(n=1528)的一半,PFS的KM曲线与原始文章的曲线几乎完全相同(e图1A)。贝伐珠单抗与病情进展风险降低的关系在大约6个月时达到顶峰,然后在大约12个月时消失。即使是巢癌以外的癌症类型,贝伐珠单抗的PFS差异也往往在12个月左右达到最大。贝伐珠单抗是一种抗血管内皮生长因子-A抗体,其主要作用是抑制肿瘤组织的血管生成,理论上可使肿瘤组织缺氧、缺养分,诱导肿瘤细胞凋亡和坏死,但几乎没有直接的细胞杀伤作用。相反,贝伐珠单抗治疗过程中会出现的缺氧诱导、不依赖血管内皮生长因子的延迟血管生成可能是肿瘤进展和复发的原因。早期研究报告称,抗血管内皮生长因子抗体恢复血管结构和功能可能会改善血液灌注和细胞毒性药物向肿瘤的给药,但最近的一项研究报告称,联合使用抗血管内皮生长因子抗体反而会降低细胞毒性药物在肿瘤内的浓度。此外,GOG-0218研究中与贝伐珠单抗的联合用药并没有显示出对反应率的改善。一项研究报告称血管内皮生长因子具有肿瘤免疫抑制作用,因此人们期望抗血管内皮生长因子抗体能激活抗肿瘤免疫,但另一项研究报告称,抗血管内皮生长因子抗体诱导的缺氧反而抑制了抗肿瘤免疫。总之,目前的证据表明,贝伐珠单抗的主要作用被推测为单纯的细胞抑制作用,而非细胞毒性作用。

图4:基于图像的贝伐珠单抗一线治疗3期试验卡普兰-梅耶曲线分析

图5:基于图像的复发性贝伐珠单抗3期试验卡普兰-梅耶曲线分析
在本研究中,按浆液性亚型和非浆液性亚型分层的ICON7-A队列分析显示,只有浆液性亚型观察到反弹,而非浆液性亚型则没有(图2;e图3)。据我们所知,这是第一份显示不同组织学亚型巢癌贝伐珠单抗治疗效果差异的报告。贝伐珠单抗被认为在肿瘤细胞生长直接依赖于血管内皮生长因子信号时最为有效,而在一些浆液型病例中,有报道称癌细胞表达高水平的血管内皮生长因子受体。换言之,不同组织学亚型对血管内皮生长因子依赖性的差异可能与贝伐珠单抗的疗效有关。此外,浆液性亚型通常对初始化疗反应良好,但与非浆液性亚型相比,其复发和耐药性增加的情况更为常见。浆液型的这一临床特征也可能与其他组织学类型的结果差异有关。
ICON7和GOG0218的亚组分析结果表明,随着时间的推移,进展风险比的变化和反弹与患者是高风险还是低风险、有无HRD以及对化疗敏感还是耐药无关。鉴于贝伐珠单抗的有效期似乎只有一年左右,且停药后会出现反弹,因此贝伐珠单抗的益处,包括生存期和生活质量的改善,很可能只出现在生存期较短的患者身上。我们的发现或许可以解释之前的研究结果,即贝伐珠单抗在ICON7和GOG-0218总体队列中没有延长总生存期,但在化疗难治的高危患者中延长了总生存期。
复发性巢癌研究中没有出现反弹效应(e图5A-C),这似乎与在疾病进展前不停止贝伐珠单抗的方案有关。在MITO-16B试验中也观察到了类似的结果,患者在一线治疗中接受贝伐珠单抗,在复发疾病中再次接受贝伐珠单抗治疗(e图5D)。这表明贝伐珠单抗是一种单纯的生长抑制剂,不会像细胞毒性药物那样诱导复发肿瘤的克隆选择。鉴于复发患者的中位PFS和总生存期短于接受一线治疗的患者,贝伐珠单抗可能会给复发患者带来更多益处。
在PAOLA-1试验中,与安慰剂相比,奥拉帕利联合贝伐珠单抗可显著延长HRD患者的PFS。在原发肿瘤剥除手术后无残留肿瘤的患者中,奥拉帕利组的2年PFS明显较好:在BRCA基因突变病例中,奥拉帕利组的2年生存率高达96%;在BRCA野生型的HRD病例中,奥拉帕利组的2年生存率为80%。目前正在进行一项3期试验,以评估在服用尼拉帕利的情况下加入贝伐珠单抗的疗效。这项研究的结果可能会明确PARP抑制剂维持治疗是否能减少贝伐珠单抗停药后的病情进展。
本研究的局限性在于无法获得ICON7和GOG-0218试验整个组群的个体患者数据。这可能会导致潜在的偏倚,尤其是在病例数较少的亚组分析中,如非肉芽肿型。此外,本研究使用的KM曲线图像分析无法进行统计分析,因此无法从科学严谨的角度得出结论。本研究的结果需要在今后的研究中加以验证。
这项队列研究的结果表明,贝伐珠单抗用药与巢癌进展风险的关联随着时间的推移而变化。考虑到贝伐珠单抗在完成浆液性巢癌一线治疗后会出现反弹,因此贝伐珠单抗可能最适用于受反弹影响较小的患者,即预期生存期少于1年的患者。贝伐珠单抗与PARP抑制剂的联合使用还需进一步研究。
近期活动



本文作者可以追加内容哦 !

