【引言】为什么要写公司深度文章,因为我们面对的投资噪音太多,经常只见树木不见森林,无法了解生意的本来面貌。我们立足于公开信息,客观理性分析,提出深度观点,还原生意本质。
【声明】本人秉持立足公开信息,客观理性分析。不主观臆断,有几分证据说几分话。写文章的目的是供志同道合的朋友交流探讨。人身攻击发泄情绪的人奉劝远离为好,你爱看不看。为了净化本帖空气,规则如下:韭菜脑,张口闭口庄托骂人,及人身攻击者一律拉黑!

【前言】昨天刚梳理了艾本那肽的重要时间线,今天盘后突发艾本那肽注射液上市许可获得NMPA受理的公告。基于此,系统性梳理药品注册环节,写一写药品注册流程。
注:NMPA是中国药品监督管理局的英文缩写,National Medical Products Administration。
在开始正文之前,需要简评一下广为传播的“速胜论”和"持久战”两种观点。
之前不少朋友一直说常山药业的艾本那肽马上就可以得到NMPA的上市批准(比如说三五天,一两个月等等),这是犯了“速胜论”的急性病。(今天)之前艾本那肽的上市注册(NDA)都没有获得受理,审批上市更是无从谈起。
另外也有不少朋友说常山药业的艾本那肽从被NMPA受理到正式批准需要数年之久,这是犯了“持久战”的慢性病。作为1.1类创新药的受理到批准时间,虽然不能准确预判,但是大致时间是可以推算的。
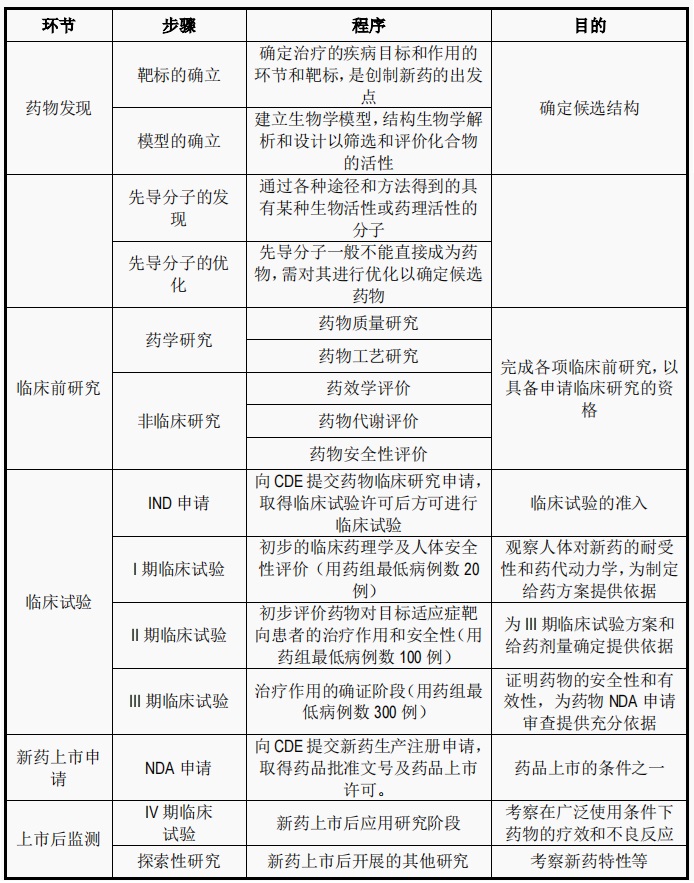
一款药从“十月怀胎”到“哌哌落地”的阶段
一款药从药物研发到上市大致需要经历五个大的阶段。分别是药物发现,临床前研究,临床试验(IND),新药上市申请(NDA)和上市后监测五个阶段。其中最为重要的是临床试验(IND)和新药上市申请(NDA)这两个阶段。
两部法律法规
具体流程主要由2019年12月1日起施行的《中华人民共和国药品管理法》(2019 年修订)及2020年7月1日起施行的《药品注册管理办法》两个文件进行规定。
《药品管理法》主要对药品的研制、生产、经营、使用和监督管理活动进行规范。具体细节条款不再赘述,相对于老法有一条比较大的变动,新批准上市的药品发放药品注册证书及附件,不再发放新药证书。没有新药证书!没有新药证书!没有新药证书!取而代之的是药品注册证书!药品注册证书!药品注册证书!
《药品注册管理办法》(下称管理办法)主要规范药品研制、注册其及监督管理活动。管理办法第三条:申请人取得药品注册证书后,为药品上市许可持有人。常山药业的公告表述是:艾本那肽的上市许可申请获得受理,也就是药品注册获得受理,一个意思!
药品注册流程
药品注册包括药物临床试验申请(IND)、药品上市许可申请(NDA)、补充申请、再注册申请等许可事项,以及其他备案或者报告事项。
一、药品注册分类
药品注册申请类别,按照中药、化学药和生物制品等进行分类注册管理。其中化学药注册分类包括按照化学药创新药、化学药改良型新药、仿制药等进行分类。常山药业艾本那肽为化学药创新药注册,即1.1类。
根据NMPA2020年6月29日发布的《化学药品注册分类及申报资料要求》,化学药品注册分类分为创新药、改良型新药、仿制药、境外已上市境内未上市化学药品,分为以下5个类别:
1类:境内外均未上市的创新药。指含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。
2类:境内外均未上市的改良型新药。指在已知活性成份的基础上,对其结构、剂型、处方工艺、给药途径、适应症等进行优化,且具有明显临床优势的药品。
3类:境内申请人仿制境外上市但境内未上市原研药品的药品。该类药品应与参比制剂的质量和疗效一致。
4类:境内申请人仿制已在境内上市原研药品的药品。该类药品应与参比制剂的质量和疗效一致。
5类:境外上市的药品申请在境内上市。
1类药进一步细分为以下6种:
(1)通过合成或者半合成的方法制得的原料药及其制剂;
(2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂;
(3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂;
(4)由已上市销售的多组份药物制备为较少组份的药物;
(5)新的复方制剂;
(6)已在国内上市销售的制剂增加国内外均未批准的新适应症。
常山药业的艾本那肽属于1.1类药。
二、药物临床试验
药物临床试验,是指以药品上市注册为目的,为确定药物安全性与有效性而在人体开展的药物研究。药物临床试验分为Ⅰ期临床试验、Ⅱ期临床试验、Ⅲ期临床试验、Ⅳ期临床试验以及生物等效性试验。
对药物临床试验申请应当自受理之日起六十日内决定是否同意开展药物临床试验,符合要求的发给《药物临床试验批准通知书》。这里很多人有个误区:常山药业在2013年艾本那肽临床试验获得批准发给的是《药品注册申请受理通知书》,很多人据此说常山药业在2013年临床的时候就提报了新药注册申请NDA,搞出个大乌龙。这是错误的,旧的《药品注册管理办法》对临床试验和新药注册申请全部都是用“药品注册申请”,并未在字面上区分。新的药品管理办法在这一点进行了改进,名称上进行了明确区分!给国家的进步点赞!
已获准上市的药品增加适应症(或者功能主治)需要开展药物临床试验的,应当向药品审评中心提出新的药物临床试验申请。这里艾本那肽降糖适应症获批后,若新增其他适应症,应当从临床试验开始,而不是很多人说的直接适应症申报注册,不用临床试验!
三、药品上市许可
这个环节通俗来讲就是大家常常说的NDA环节,也叫药品注册环节。
药品审评中心应当组织药学、医学和其他技术人员,在规定时限内按要求对已受理的药品上市许可申请进行审评。综合审评结论通过的,批准药品上市,发给药品注册证书。
药品审评中心在审评药品制剂注册申请时,对药品制剂选用的化学原料药、辅料及直接接触药品的包装材料和容器进行关联审评。药品审评审批环节,需要经历药品注册核查、药品注册检验等环节。
被药品审评中心受理的药品,在国家药品监督管理局药品审评中心网站-信息公开-审评任务公示栏进行亮灯环节。这里有“药理毒性,临床,药学,统计,临床药理,合规”六个环节。六个环节结束,进入综合审评阶段,最终药品审评完成!

四、药品加快上市流程
新的法规共有四类加快上市审批程序,分别是“突破性治疗药物程序”“附条件批准程序”“优先审评审批程序”“特别审批程序”。具体条款大家自行查看法规,目前没有明显证据可以证明艾本那肽符合以上的四条中的任何一条。有可能争取的是优先审评审批程序”的第六条,即:
药品上市许可申请时,以下具有明显临床价值的药品,可以申请适用优先审评审批程序:(一)临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药;(二)符合儿童生理特征的儿童用药品新品种、剂型和规格;(三)疾病预防、控制急需的疫苗和创新疫苗;(四)纳入突破性治疗药物程序的药品;(五)符合附条件批准的药品;(六)国家药品监督管理局规定其他优先审评审批的情形。
在新的药品注册管理办法出台之前(依据总局关于鼓励药品创新实行优先审评审批的意见(食药监药化管〔2017〕126号)),艾本那肽符合优先审评审批政策。新办法出台后进行了重新规范(国家药监局关于实施《药品注册管理办法》有关事宜的公告(2020年 第46号)),进行了排除,公告第六条:优先审评审批的范围和程序按以下规定执行:
(一)新《办法》发布前受理的药品注册申请,按照《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号)规定的范围和程序执行。
(二)新《办法》发布至实施前受理的药品注册申请,按照新《办法》规定的范围和《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号)规定的程序执行。
(三)新《办法》实施后受理的药品注册申请,按照新《办法》规定的范围和程序执行。
艾本那肽属于第(三)款约定的情形。基于此,暂时无法判定是艾本那肽否符合药品加快上市流程。
药品上市许可申请审评时限为二百日,其中优先审评审批程序的审评时限为一百三十日,以上为工作日。
保守估计,顺利的话艾本那肽NDA时间从受理到获批的时间在一年左右(自然日)。
特别说明:若有其他新的证据表明可以大大缩短审评时间,后续及时更新。也欢迎大家探讨,提出意见!
风险提示:本内容仅代表破卷研究的分析、推测与判断,登载于此仅出于传递信息之目的,不作为投资具体标的之依据。投资有风险,入市需谨慎!
版权声明:本内容版权归原创方或原作者所有,如转载使用,请注明来源及作者、文内保留标题原题以及文章内容完整性,并自负版权等法律责任。
$常山药业(SZ300255)$
本文作者可以追加内容哦 !

