【引言】为什么要写公司深度文章,因为我们面对的投资噪音太多,经常只见树木不见森林,无法了解生意的本来面貌。我们立足于公开信息,客观理性分析,提出深度观点,还原生意本质。
【声明】本人秉持立足公开信息,客观理性分析。不主观臆断,有几分证据说几分话。写文章的目的是供志同道合的朋友交流探讨。人身攻击发泄情绪的人奉劝远离为好,你爱看不看。为了净化本帖空气,规则如下:韭菜脑,张口闭口庄托骂人,及人身攻击者一律拉黑!

【前言】昨天已经在文章中推算了注册受理到审批的时间周期大约在1个自然年,结果还是有很多人说受理到审批只需要20个工作日,这明显是不对的!今天就《药品注册管理办法》的规定简要梳理一下药品注册审批时限。
一、药品注册
依据《药品注册管理办法》第四条,药品注册包括药物临床试验申请、药品上市许可申请、补充申请、再注册申请等许可事项,以及其他备案或者报告事项。申请人取得药品注册证书后,为药品上市许可持有人。
其中最重要且最耗时间的是药品上市许可申请,目前常山药业处于这个环节,也就是常说的NDA环节。
二、药品上市许可
根据《药品注册管理办法》第三十四条,申请人在完成支持药品上市注册的药学、药理毒理学和药物临床试验等研究,确定质量标准,完成商业规模生产工艺验证,并做好接受药品注册核查检验的准备后,向药品审评中心提出药品上市许可申请,按照申报资料要求提交相关研究资料;药品审评中心经对申报资料进行形式审查,符合要求的,出具《受理通知书》;不符合要求的,出具《不予受理通知书》或者《申请材料补正通知书》,并说明理由予以受理。
药品上市许可(审评审批)包括三个大环节:药品审评、行政审批及颁发证书。
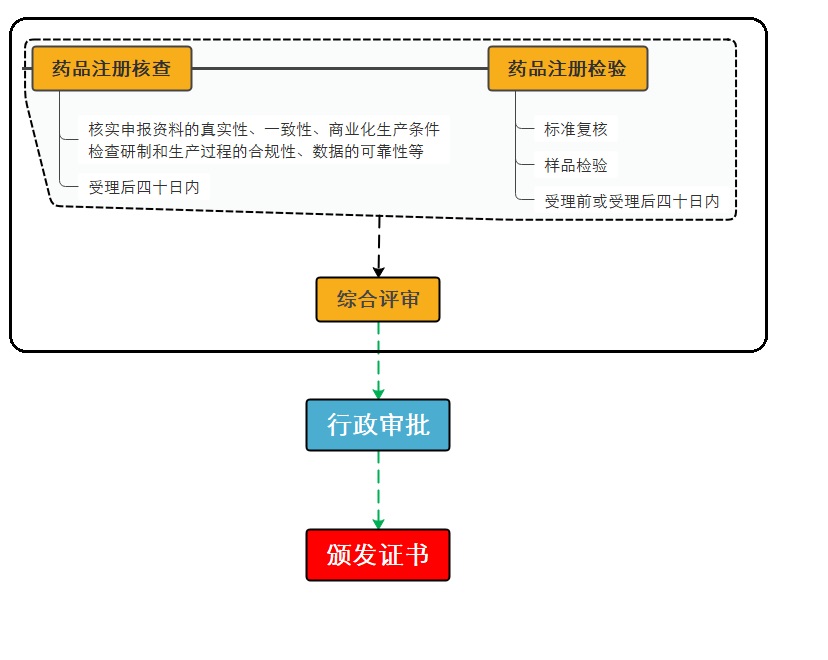
(1)药品审评环节
药品审评中心应组织药学、医学和其他技术人员,在规定时限内按要求对已受理的药品上市许可申请进行审评。审评过程中基于风险启动药品注册核查、检验,相关技术机构应当在规定时限内完成核查、检验工作。
药品审评环节包括药品注册核查、药品注册检验以及综合评审三个步骤。
药品注册核查:是指为核实申报资料的真实性、一致性以及药品上市商业化生产条件,检查药品研制和生产过程的合规性、数据可靠性等,对研制现场和生产现场开展的核查活动,以及必要时对药品注册申请所涉及的原辅包品种化学原料药、辅料及直接接触药品的包装材料和容器生产企业、供应商或者其他受托机构开展的延伸检查活动。
药品注册检验:包括标准复核和样品检验。
综合评审:药品审评中心根据药品注册申报资料、核查结果、检验结果等,对药品的安全性、有效性和质量可控性等进行综合审评,非处方药还应当转药品评价中心进行非处方药适宜性审查。
(2)行政审批环节
药品审评环节完成后,监管部门对审评报告、核查报告、检验结果进行全面审核,做出是否批准药品上市的决定。
(3)颁发证书环节
药品监督管理部门应当自作出药品注册审批决定之日起十日内颁发、送达有关行政许可证件。
三、上市许可申请受理到获批的时限
药品上市许可(审评审批)的时限与药品审评、行政审批及颁发证书的时间相关。
药品上市许可申请审评时限为二百日,其中优先审评审批程序的审评时限为一百三十日。
行政审批时限为二十日。
药品监督管理部门应当自作出药品注册审批决定之日起十日内颁发、送达有关行政许可证件。
综上,上市许可申请受理到获批的时限最长为二百三十日。
注:以上各环节均是最长法定时限,单位为工作日。
风险提示:本内容仅代表破卷研究的分析、推测与判断,登载于此仅出于传递信息之目的,不作为投资具体标的之依据。投资有风险,入市需谨慎!
版权声明:本内容版权归原创方或原作者所有,如转载使用,请注明来源及作者、文内保留标题原题以及文章内容完整性,并自负版权等法律责任。
本文作者可以追加内容哦 !

