后浪森林研究室|洛上洲
统筹、编辑|许佳维
智翔金泰被后浪森林研究室定义为创新药四小龙榜二榜三,源于其深厚累积的自免、肿瘤、感染性管线及重磅单品,以及其企业治理能力、商业化能力、厚实的资本背景。
近期这家企业有一个极重要的信息,对企业未来价值产生深入影响。
它将在6月14日参加欧洲血液协会(EHA)2024年会,并向会议报告GR1803(一种BCMA×CD3双特异性抗体)在复发/折射多发性多发性肌瘤患者中的安全性和有效性的I期临床数据。
较之以往,外部更多对这家企业所研发的产品所认知的是IL-17A靶点的GR1501(中重度银屑病)、RABV-G靶点的GR1801(狂犬病被动免疫适应症)、IL-4R靶点的GR1802(哮喘适应症、慢性自发性荨麻疹、特应性皮炎、慢性鼻窦炎伴鼻息肉)。而GR1803因距研究终点较早而较少为公众所知。
GR1803惊喜亮相欧洲血液年会背后的临床数据
这份载于“EHA”的公开资料,其报告所称的“评估GR1803(一种BCMA×CD3双特异性抗体)在复发/折射多发性多发性肌瘤患者中的安全性和有效性的I期单一疗法研究”,显示了其极具优势的临床数据。
方法:
RRMM的成年患者在先前的治疗后复发或难治,包括蛋白酶体抑制剂、免疫调节药物和抗CD38抗体,24周内每周静脉给药一次。根据国际骨髓瘤工作组(IMWG)标准(2016年),患者患有可测量的疾病。
该研究分为2个部分:剂量升级(第1部分)和扩展(第2部分)。16名患者被纳入8个剂量升级队列中的1个(0.02-360 ug/kg)。剂量升级从0.02 ugkg剂量开始,前3个队列的单患者加速滴定阶段,然后是“3+3”设计的标准滴定阶段。180和240 ug/kg剂量水平进一步扩大,分别为 22和12名患者。
结果:
截至2024年1月18日,该项目己招收了50个科目。在2024年1月31日的数据截止日期,49名(98%)受试者至少经历了一次治疗紧急不良事件(TEAE),48名(96%)受试者的TEAE等级≥3。常见(≥20%)TEAE包括感染70%(38% Gr3),细胞因子释放综合征 80%(6% Gr ≥3),发烧40%(4%Gr≥3),贫血70%(32% Gr≥3),中性粒细胞减少症76%(50% Grz 3),血小板减少症64%(48%Gr≥3),自细胞减少症66%(32% Gr≥3),淋巴细胞减少症62%(60% Gr≥ 3),低钾血症52%(16% Gr=3)和腹泻38%(8% Gr≥3)。在360ug/kg剂量治疗队列中,2名患者可评估限制剂量毒性(DLTS)。
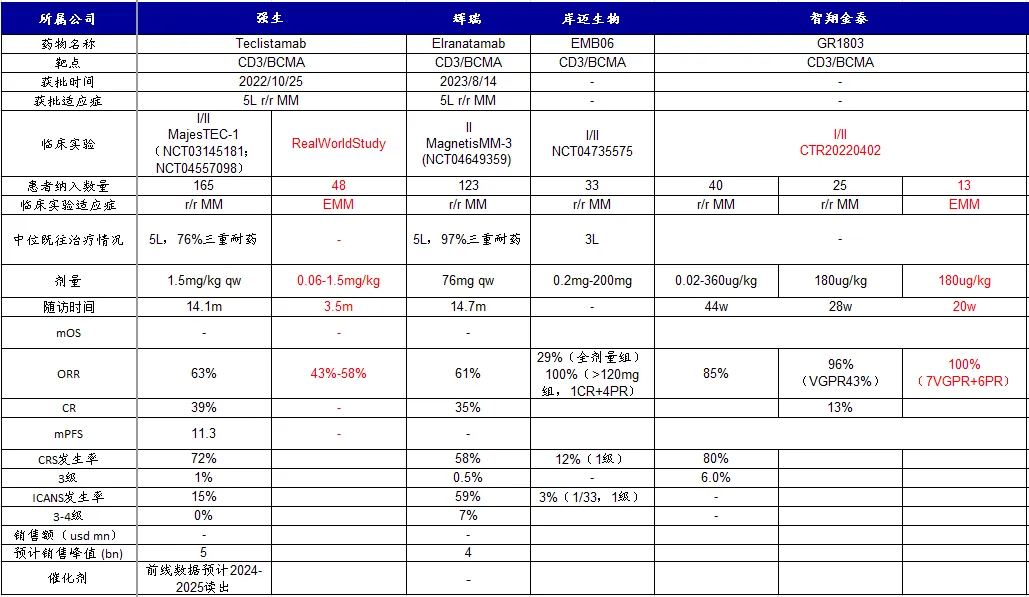
现在40名患者至少接受了一次疗效评估。40名可评估受试者的总体ORR为85%(34/40),绝大多数缓解期患者仍在接受治疗,随访时间长达 44周。180ug/kg剂量队列共登记了25名受试者,随访时间中位数为28周(范围为3-32周)。
在25名患者中,23名受试者至少接受了一次疗效评估,ORR为96%(22123),VGPR发病率为 43%,CR发病率为13%。接受180ug/kg剂量注射的13名髓外多发性骨髓瘤(EMM)患者的随访时间为20周(范围为10周-25周)。总体疗效评估ORR为有7个VGPR和6个PR.100%(13/13),
大多数患者在第一次疗效评估时实现了PR及以上的缓解,中位发病时间为3周。通过持续治疗,受试者的缓解得到了持续和进一步改善。对于尚未达到缓解(SD,MR)或已达到 PR但尚未达到VGPR和更高疗效的患者,所有疗效指标都在逐步下降。在25名患者的中位随访中位数为7个月,没有达到无进展生存率(mPFS)中位数,缓解持续时间中位数(mDOR)没有到达。所有缓解的受试者都尚未经历疾病进展。
摘要/结论:GR1803治疗具有良好的耐受性,具有出色的抗骨髓瘤活性,特别是在EMM患者中。GR1803有望改善RRMM患者的预后。随着更长的后续行动,将提供额外的功效/安全性数据。
“MM”探索
多发性骨髓瘤(Multiple Myeloma,MM)是一种恶性浆细胞瘤,产生单克隆免疫球蛋白,侵犯并破坏邻近骨组织。常见临床表现包括引起疼痛或骨折的溶骨性病变、肾功能不全、高钙血症、贫血和反复感染。在很多国家它是血液系统第2位常见恶性肿瘤,多发于老年,目前仍无法治愈。
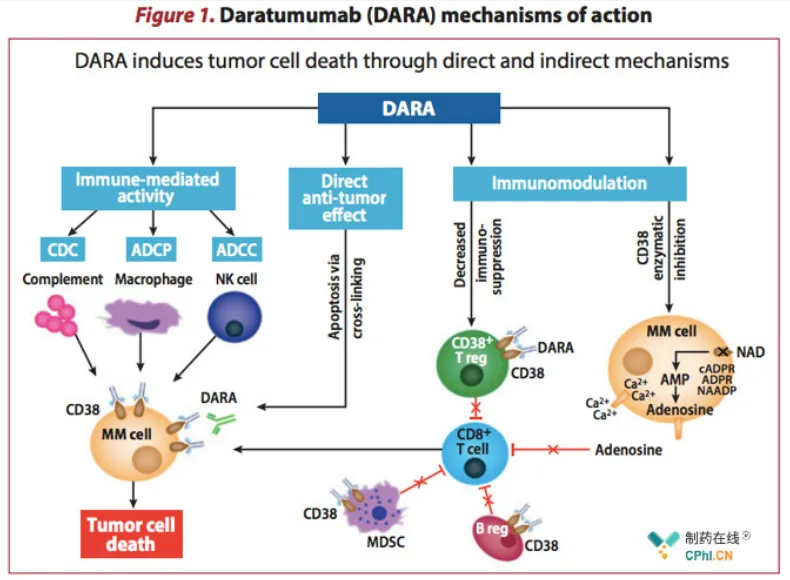
GR1803基于共同轻链构建的双特异性抗体分子,结构与正常的单抗分子结构高度类似,只在抗体恒定区CH3中存在3个氨基酸突变。GR1803同时结合抗原BCMA和CD3,其结合BCMA的亲和力(10-10M)比结合CD3的亲和力(10-8M)高两个数量级。这种非对称的亲和力设计在保证此双特异性抗体分子募集并激活T细胞杀伤肿瘤细胞同时,可以有效减少因CD3抗体导致T细胞非特异性激活,从而降低GR1803在体内的毒副作用。
MM在我国多发性骨髓瘤新发病人数由2016年的1.89万上升到2020年的2.11万,并有可能在2030年达到2.81万。美国癌症协会数据显示,早期多发性骨髓瘤的五年生存率为74%,晚期为51%。
多发性骨髓瘤分为无症状(冒烟型)及有症状(活动性)。目前MM的治疗药物主要包括烷基化剂、蛋白酶体抑制剂、免疫调节剂、抗体药物及其他肿瘤药。
——烷基化剂,总有效率为95%,严格意义完全缓解率16%;
——蛋白酶体抑制剂,总缓解率为27.7%,完全缓解率为2.7%;
——免疫调节剂,总最佳缓解率47.6%,完全缓解率3.7%;
——抗体药物,比较本品+硼替佐米+地塞米松(DVd)与硼替佐米+地塞米松治疗(Vd),接受DVd治疗的疾病进展或死亡风险相比接受Vd治疗降低72%,DVd和Vd的总缓解率分别为82.5%和65.1%。
辉瑞制药的BCMAxCD3双抗药物Elranatamab的Magnetis MM-3注册试验中期数据显示,其客观缓解率为60.6%,其中89.5患者客观缓解仍在进行中。
强生的BCMAxCD3双抗药物Teclistamab的MajesTEC-1注册试验数据显示,其客观缓解率为63.3%,完全缓解率为39.4%。

同赛道研发进展
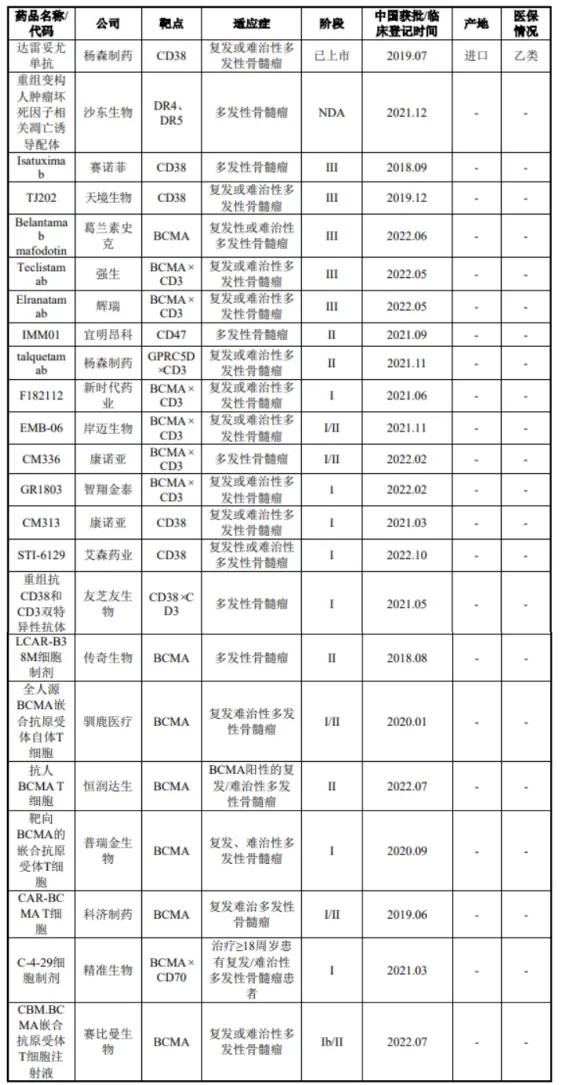
目前全球研发多发性骨髓瘤的企业有21家。除杨森制药CD38靶点的达雷妥尤单抗2019年上市外,其余均在研发进程中。
最临近上市的是沙东生物的重组变构人肿瘤坏死因子相关凋亡诱导配体,三期临床的包括赛诺菲的Isatuximab、天境生物的Tj202、GSK的Belanamab、强生的Teclistamab和辉瑞的Elrastamab。
$智翔金泰-U(SH688443)$$智飞生物(SZ300122)$
本文作者可以追加内容哦 !

