石药集团 CLDN18.2 ADC
2022 年 7 月 28 日,石药集团宣布与 Elevation Oncology, Inc. 就 SYSA-1801 (CLDN 18.2)在大中华区以外地区的开发及商业化订立独家授权协议,石药子公司巨石生物将保留大中华区权益。
此次ASCO公布的是一项开放标签、多中心 I 期临床,评估既往治疗后进展、或对标准疗法不耐受、或无标准治疗方案的 CLDN18.2 阳性实体瘤患者中 SYSA-1801 的安全性、耐受性、药代性质和有效性,试验登记号为 NCT05009966。
这项试验包括 2 部分:第 1 部分是改良的 3+3 剂量递增设计,评估 5 个剂量水平的 SYSA1801(0.5, 1, 2, 2.5 和 3 mg/kg)每 3 周一次(Q3W)静脉给药(IV),随后以有效剂量扩展剂量。第 2 部分是基于最佳剂量的剂量扩展队列。本次公布的结果为第 1 部分初步结果。
截至 2022 年 11 月 5 日,共入组 33 例患者,中位年龄为 59 岁(范围 22-71)。26 例患者(78.8%)为胃癌,7 例患者(21.2%)为胰腺癌。ECOG PS 评分为 0 的患者有 5 例(15.2%),评分为 1 的有 28 例(84.8%)。11 例患者既往接受过重度预处理(即既往治疗线数 ≥3)。
任何级别的治疗相关不良反应(TRAEs)发生在 25 例患者中(75.8%),其中 8 例发生不小于 3 级的不良反应。无治疗相关死亡报道。最常见的 TRAEs(发生在 >20% 患者中)为恶心(42.4%)、呕吐(36.4%)、干眼综合征(21.2%)和贫血(21.2%)。在 3 mg/kg 剂量组发生了 2 例剂量限制毒性(DLTs),为 3 级恶心和呕吐,最佳剂量仍在探索中。
有效性方面,33 例入组患者中共 21 例可评估,ORR 为 38.1% (95% CI: 18.1-61.6%, 8 PRs),DCR 为 57.1% (95% CI: 34.0-78.2%, 4 SDs)。
在 17 例可评估胃癌患者中,ORR 和 DCR 分别为 47.1% (95% CI: 23.0-72.2%, 8 PRs) 和 64.7% (95% CI: 38.3-85.8%, 3 SDs)。1 mg/kg 剂量组有 1 例胃癌患者耐受治疗 44 周,并在分析中表现出可持续的部分缓解(PR);1 例 2mg/kg 剂量组患者既往曾接受抗 CLDN18.2 治疗失败,在 SYSA-1801 治疗后实现 PR。
结果显示,SYSA-1801 在复发/难治性 CLDN18.2 阳性实体瘤中表现出了值得期待的早期疗效信号,同时安全可耐受。
瀚森制药 B7-H3 ADC
HS-20093 是翰森制药进展最快的 ADC 药物,目前已进展至II期,本次公布的是一项多中心、开放标签I期首次人体临床试验,在晚期实体瘤中评估 HS-20093,试验登记号为 NCT05276609,代号为 ARTEMIS-001。
剂量递增阶段评估静脉注射 1.0 至 16.0 mg/kg HS-20093 的安全性和耐受性,采用加速滴定和间隔 3+3 设计。入组患者为既往接受过前线标准疗法的患者,HS-20093 每 3 周一次静脉注射。
截至 2022 年 12 月 20 日,这项研究完成了所有计划内的剂量队列。在剂量递增阶段,共 53 例患有不同实体瘤的患者入组,接受了 ≥ 1 剂的 HS-20093 输注。具体瘤种上包括 29 例非小细胞肺癌,11 例小细胞肺癌,9 例肉瘤和 4 例其他晚期实体瘤。基线水平看,25 例(47.2%)患者接受了 ≥3 线前线治疗,平均前线治疗线数为 3.2(范围 1-12)。
3 位患者经历了剂量限值毒性(1 例在 12.0 mg/kg,2 例在 16.0 mg/kg),最高耐受剂量为 12.0 mg/kg。TEAEs 在 53 例患者(100%)中发生,≥ 30% 的患者中发生的不良反应为白细胞减少、中性粒细胞减少、贫血、发热、恶心、血小板减少、低白蛋白血症、呕吐、淋巴细胞减少、输液相关反应和疲劳,未报告间质性肺炎。
在 40 例可评估患者中,无论基线 B7-H3 表达水平如何,在 4-12 mg/kg HS-20093 治疗的患者中观察到14例部分缓解,ORR为 35.0%,包括了9例已确认的PR和5例待确认 PR。DCR为 85.0%(35/40, 95% CI: 70.2-94.3)。治疗持续时间最长的患者(349 天)仍在治疗中。
分癌种来看,在 9 例 SCLC 患者中,观察到了 7 例 PR(ORR 为 77.8%),中位响应深度为 50.5%,包括 3 例确认的 PR 和 4 例待确认 PR。CLC 患者的所有反应均发生在第一次疾病评估时,首次反应的中位时间为 6 周。
百利天恒 EGFR/HER3 ADC
BL-B01D1 是一款 EGFR/HER3 双抗 ADC,载荷为新型 TOP1 抑制剂。
本次公布的是 I 期临床结果(登记号:NCT05194982),纳入局部晚期或转移性实体瘤患者,在剂量递增(D-ESC,i3+3)部分以 0.27、1.5、3.0 mg/kg QW,2.5、3.0、3.5 mg/kg D1D8 Q3W 或 4.5、5.0、6.0 mg/kg D1 Q3W 静脉内给药。部分患者被纳入 Q3W 方案的剂量扩展(D-EXP)部分。
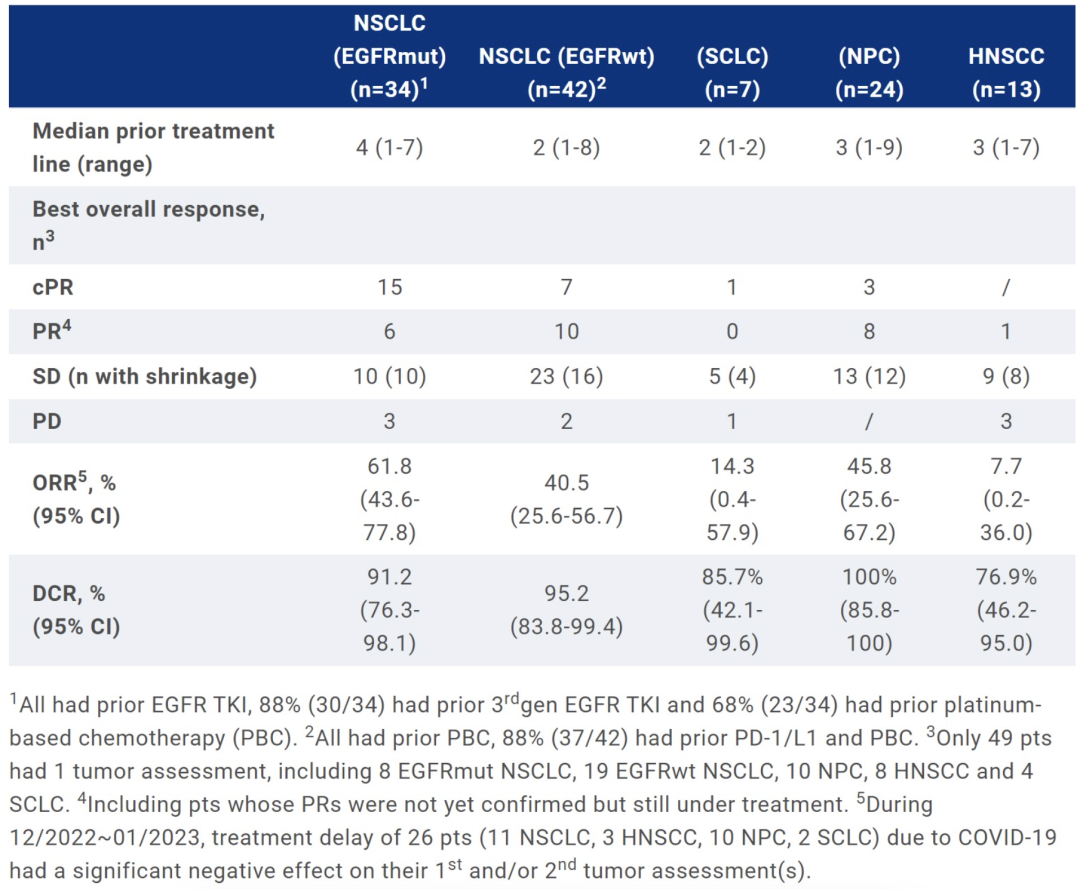
截至 2022 年12月31日,试验共入组 150 名至少接受 1 剂治疗的患者(D-ESC,n=25;D-EXP,n=125)。DLT 为 3.0 mg/kg QW 和 3.5 mg/kg D1D8 Q3W 时的中性粒细胞减少症、发热性中性粒细胞降低症和血小板减少症。MTDs 分别为 3.0 mg/kg D1D8 Q3W 和 6.0 mg/kgD1 Q3W。在 2.5、3.0 mg/kg D1D8 Q3W 和 4.5、5.0、6.0 mg/kg D1Q3W 下进行 D-EXP。
144 名受试者被纳入 Q3W 剂量组(D-ESC 和 D-EXP),包括 89 例 NSCLC、7 例 SCLC、27 例鼻咽癌(NPC)、19 例 HNSCC 和 2 例其他肿瘤。最常见的 TRAE(10%,所有级别/≥G3)为白细胞减少症(60%/30%)、中性粒细胞减少症、贫血(45%/15%)、血小板减少症(44%/19%)、脱发症(30%/0%)、恶心症(29%/1%)、呕吐症(28%/0%)、乏力(21%/1%)和皮疹(13%/0%)。未观察到 ILD。
122 例患者可评估疗效,其疗效数据如下:
关注wechat药研网
参考:insight数据库
本文作者可以追加内容哦 !

