据EvaluatePharma预测,全球血液病药物市场规模将从2021年的590亿美元扩张至2028年的1090亿美元[1]。这个蓬勃的市场吸引着国内外一众药企入场角逐,而罗氏早已凭借极具前瞻性的眼光在血液病领域成功开拓一方天地,一系列各具特色的产品铸就其无可撼动的霸主地位。

从1997年诞生的利妥昔单抗开始,罗氏领衔开启B细胞淋巴瘤靶向治疗的先河。之后,奥妥珠单抗、维奈克拉和艾美赛珠单抗相继问世,不断满足淋巴瘤、白血病和A型血友病患者的未尽之需。如今,维泊妥珠单抗登陆中国,有望重塑一线弥漫性大B细胞淋巴瘤(DLBCL)江湖秩序;两款重磅CD20/CD3双抗mosunetuzumab和glofitamab成功撞线,正在颠覆淋巴瘤患者新的治疗体验和格局。
罗氏在血液病领域缔造的彪炳战绩或许会给人错觉,认为这是一个开发难度不高、容易突破的赛道。事实上,迄今为止已有不少制药巨头在该领域遭遇滑铁卢。2010年,因无法证明临床获益且有致死风险,辉瑞的急性髓系白血病(AML)药物吉妥珠单抗奥唑米星黯然撤市。2022年,治疗血液肿瘤的PI3K抑制剂卷入安全性风波,吉利德的艾德拉尼和拜耳的copanlisib等均蒙上阴霾。同年,GSK旗下用于多发性骨髓瘤(MM)的belantamab mafodotin由于未达III期验证性研究主要终点退市……
面对充满挑战的血液病领域,罗氏为何能屹立于巅峰二十多年不倒,甚至敢于自我革新,不断开发出超越经典的创新产品?未来围绕血液学疾病市场作了哪些重点规划,又是基于什么逻辑进行产品管线的迭代布局?
恰逢“2023罗氏血液高峰论坛”召开之际,罗氏全球血液疾病领域负责人Dr. Peter Ahnesorg、罗氏全球血液(NHL/CLL)研发负责人Dr. Ginna Laport和罗氏全球血液(MM)研发负责人Dr. Marion Ott 3位相关负责人就上述问题接受了医药魔方的采访,展开深度分享。

Dr. Peter Ahnesorg
罗氏全球血液疾病领域负责人
超越经典,血液肿瘤走向“治愈”

血液肿瘤病理复杂且种类繁多,罗氏在开发策略上化繁为简,主要聚焦几大疾病版块——非霍奇金淋巴瘤(NHL)、髓系恶性肿瘤和血液罕见病。NHL素以高异质性著称, 其中弥漫性大B细胞淋巴瘤(DLBCL)是最常见的亚型;髓系恶性肿瘤则涵盖多发性骨髓瘤(MM)、急性髓系白血病(AML)和骨髓增生异常综合征(MDS)等。
在DLBCL领域,罗氏是当之无愧的先驱者,也是实至名归的破局者。过去二十年来,利妥昔单抗联合环磷酰胺、多柔比星、长春新碱和泼尼松的R-CHOP方案始终占据标准一线治疗高地,不过仍有多达40%的患者对该方案治疗无效或经历复发[2],伊布替尼、来那度胺等明星分子不断尝试优化R-CHOP疗法,但都纷纷落败。
这一局面直到维泊妥珠单抗的横空出世才焕然一新。它凭借III期POLARIX研究一举突破经典R-CHOP方案的疗效瓶颈。中位随访28.2个月时,维泊妥珠单抗联合治疗(Pola-R-CHP)相较于R-CHOP方案可显著延长初治患者无进展生存期(PFS),将其疾病进展、复发或死亡风险降低27%[3]。
Ginna Laport指出,维泊妥珠单抗取得如此优越的治疗获益,很重要的因素在于识别了CD79b这一全新靶标。CD79b是一种B细胞表面抗原,在超过90%的B细胞淋巴瘤中普遍表达。CD79b与抗体结合后,可触发癌细胞对抗体的快速内化,有效实现细胞毒性药物的内吞释放[4]。这些特质使之成为淋巴瘤药物开发中理想的ADC靶点。

Dr. Ginna Laport
罗氏全球血液(NHL/CLL)研发负责人
“我们用与长春新碱类似的有效载荷取代R-CHOP中的长春新碱,并将它与CD79b靶点组合。在R-CHP基础上增加维泊妥珠单抗,这是一个极大的补充,该方案因此实现了从不同角度攻击淋巴瘤细胞。”Ginna Laport对维泊妥珠单抗的精妙设计做了进一步阐明。
由此看来,维泊妥珠单抗的成功绝非偶然,既依赖于first-in-class靶点筛选与ADC作用类型的有机融合,也源自罗氏对于DLBCL病理学机制的深刻理解。
罗氏围绕DLBCL领域的排兵布阵不止于一线治疗阵地,维泊妥珠单抗与苯达莫司汀、利妥昔单抗(Pola-BR)的组合巧妙碰撞,已在中国成功获批复发/难治DLBCL适应症。此外,CD20/CD3双抗glofitamab也瞄准复发或难治性患者需求蓄势待发,其用于三线DLBCL的上市申请已获国家药品监督管理局(NMPA)优先审评。
除了glofitamab,罗氏旗下还有一款同靶点的双抗mosunetuzumab,该药物以高达80%的客观缓解率获批三线治疗滤泡性淋巴瘤(FL),代表着一种无化疗、现货型新免疫治疗选择。作为血液病领域两款相同靶点的双抗,glofitamab和mosunetuzumab究竟有何不同之处?
Ginna Laport从多重维度回答了这个问题:
第一,分子结构存在本质差别。Glofitamab具有2:1比例的CD20与CD3结合位点,可对表达CD20的恶性B细胞产生更强的靶向作用,而mosunetuzumab为典型的1:1构型。
第二,作用强度和主攻瘤种不同。Glofitamab在安全耐受的前提条件下加强了杀伤肿瘤细胞的能力,对侵袭性和难治淋巴瘤行之有效;mosunetuzumab的疗效则相对温和,细胞因子释放综合征(CRS)发生概率相对较低,更适用于治疗FL等惰性淋巴瘤。
第三,应用场景有所区别:接受glofitamab治疗的患者需要住院,而mosunetuzumab的用药场景更为灵活,适用于门诊和社区医院环境。Peter Ahnesorg进行延伸补充,他认为“选择哪一种双抗治疗有时是由疾病决定的,有时也是由实际用药环境决定的”。结合中国临床现状,会发现需要治疗的患者远比实际入院的患者多,很多患者因各种现实因素限制无法住院,而mosunetuzumab便可满足这种治疗痛点。
Ginna Laport和Peter Ahnesorg的表述中还蕴藏着另一层深意——在开发这两款双抗的最初阶段,罗氏就将差异化定位通过不同的技术平台深植于分子设计,再依据产品特征和疾病机制来雕琢两者独特的临床价值,以互补的形式触及现实中更多的治疗场景,实现更广泛的淋巴瘤患者群体覆盖。
罗氏持续引领着DLBCL的“治愈”之路,双抗联合ADC的全新应用模式成为未来重点探索方向之一。针对中国患者的研发计划也在紧锣密鼓地推进中。据Ginna Laport透露,mosunetuzumab 联合维泊妥珠单抗的大型III期SUNMO研究有望在今年夏天登陆中国,预计首批患者将于7、8月入组。
多发性骨髓瘤(MM)是发病率第二高的血液肿瘤,约占所有血液系统恶性肿瘤的10%[5,6],尽管一些新疗法提升了患者的生存率,但目前MM仍不可治愈,几乎所有患者终将面临复发。洞察到日益增长的未满足需求,罗氏运用丰富的工具箱强势布局MM领域,核心资产囊括维奈克拉、靶向FCRH5/CD3双抗cevostamab、靶向GPRC5D/CD3双抗forimtamig、同种异体CAR-T疗法P-BCMA-ALLO1等。
谈及MM领域的布局策略,Marion Ott描绘了一种创新与需求双向驱动的多元打法:“我们总的策略就是提供更多选择。针对不可治愈的MM,如果能够挖掘更多的新靶点和新治疗方案,患者就越有可能获得接近于‘治愈’的获益。同时我们也会衡量,什么样的患者适用什么样的综合疗法,又会收获什么样的结果,这将决定后续研发的走向。”

Dr. Marion Ott
罗氏全球血液(MM)研发负责人
聚焦未尽之需,血液罕见病治疗升级

血液罕见病是血液系统疾病的另一大领域。秉持着“先患者之需而行”的理念,罗氏同样重视血友病、阵发性睡眠性血红蛋白尿症(PNH)等血液罕见病患者迫切的治疗需求,这两大病种都已被纳入中国第一批罕见病目录。
血友病A由凝血因子VIII(FVIII)突变或缺失引起,全球约有90万患者[7]。过去,血友病A患者主要采取FVIII替代治疗,大多数药企供应的治疗药物也局限于各类重组FVIII。罗氏瞄准FVIII替代治疗无法规避的频繁静脉输注、FVIII抑制物产生和较高出血风险等缺陷,遵循底层创新的逻辑开发出该领域首个非因子类治疗药物艾美赛珠单抗,每4周皮下注射一次的给药模式无疑大大提高患者的依从性。
Peter Ahnesorg介绍了艾美赛珠单抗的独特之处,它是一种重组人源化双抗,通过桥接FIXa和FX来模拟FVIII的功能,从而恢复凝血过程。得益于此种独一无二的作用机制,艾美赛珠单抗不会诱导产生FVIII抑制物,使“零出血”的治疗目标成为可能。从中也不难发现,罗氏对于双抗技术的运用已淬炼到“炉火纯青”的地步。
当然,再漂亮的机制和炫目的技术最终也需要回归临床实际,艾美赛珠单抗凭借HAVEN系列研究进一步确证自身强悍的治疗实力。HAVEN 1-4研究长期随访数据显示,至少97%患者需治疗的出血次数≤3次,至少80%患者需治疗的出血次数为0[8];HAVEN 5主要聚焦中国患者;HAVEN 6关注轻中度患者。
最新的HAVEN 7研究更是直击血友病领域新生儿治疗的困局。“该遗传疾病治疗有一个最大的问题就是——什么时候可以开始预防治疗?在使用FVIII时,通常不对新生儿进行预防治疗,因为受限于静脉给药通路的建立和频繁静脉输注,通常风险大于获益。然而,患有血友病的新生儿出血风险很大,尤其以颅内出血最为严重。HAVEN 7研究结果表明,艾美赛珠单抗非常有效和安全地预防新生儿出血。” Peter Ahnesorg说道。
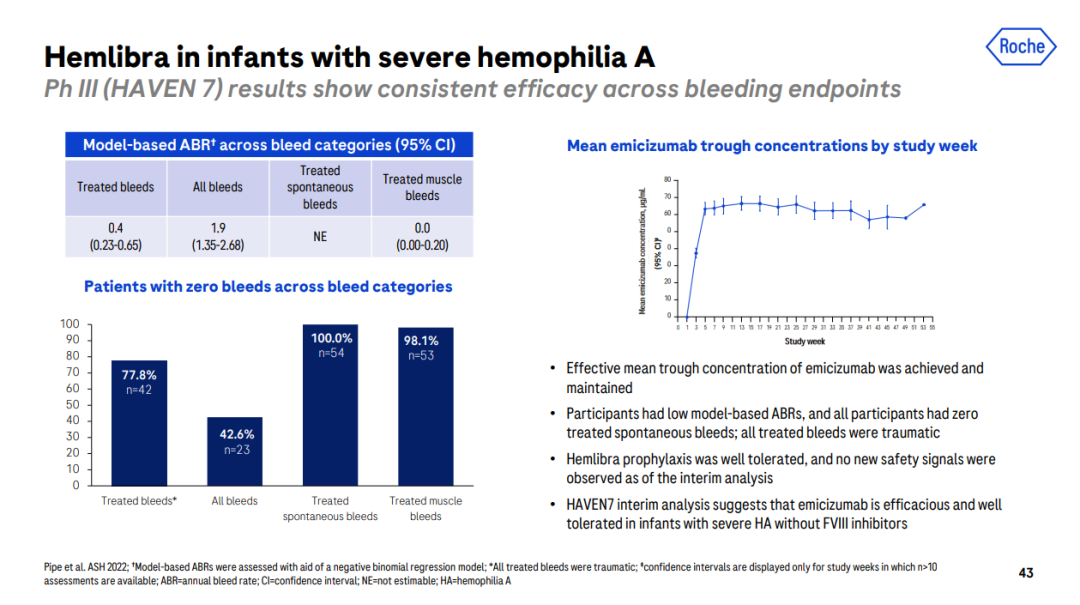
HAVEN 7研究[9]
可伐利单抗是罗氏布局阵发性睡眠性血红蛋白尿症(PNH)的重要一步。相较于传统抗体,新一代C5补体抑制剂可伐利单抗经连续单克隆抗体回收技术工程化改造后,结合力增强、半衰期延长,维持期只需每4周一次皮下注射。同时,可伐利单抗也将成为罗氏深度开拓中国市场的中坚力量,其在中国的上市申请已获NMPA优先审评,有望跃升为行业内首个早于欧美上市、实现“中国首发”的创新药。
Peter Ahnesorg深入讲述了可伐利单抗中国首发战略背后的几层考量,以及罗氏对于整个PNH疾病领域的患者需求和治疗格局的精准把握。
一方面,PNH是一种后天获得性的致命罕见病,如果不进行治疗,五年内的死亡风险高达35%[10],而77%的患者为20-40岁青壮年[11],他们的治疗需求迫切且支付能力较强。另一方面,目前PNH在中国以输血和对症治疗为主,患者通常无法达到持续有效的溶血控制,导致其生活质量严重受损。根据医药魔方数据库,中国境内虽早有获批PNH的创新疗法,但多年来迟迟无法商业化落地,中国PNH治疗长期陷入困境,罗氏认为中国患者的治疗需求尚未得到满足,才选择将这一款药物率先带到中国。
可伐利单抗在中国的快速申报上市离不开COMMODORE 3研究的成就。这是一项仅在中国开展的、评估可伐利单抗治疗PNH患者的疗效与安全性的III期研究,已于2022年5月成功达到溶血控制和避免输血的两个主要终点,在患者组织助力下,此时距离研究开始(2021年3月)也不过短短1年零2个月的时间。
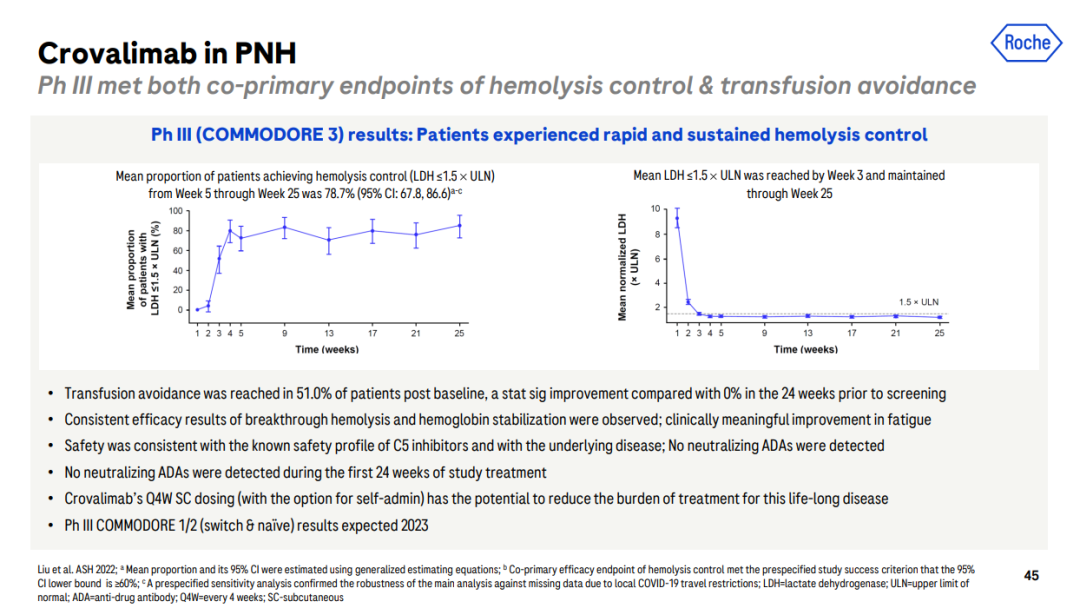
COMMODORE 3研究[9]
此外,COMMODORE 2在今年2月传来捷报,力证每4周一次皮下注射可伐利单抗非劣于依库珠单抗(每2周一次静脉注射)的疾病控制效果。据Peter Ahnesorg披露,另一项旨在探究PNH 患者从依库珠单抗转换为可伐利单抗治疗的COMMODORE 1也即将在6月的EHA大会上迎来“非常积极”的数据公布。
高瞻远瞩,血液病领导地位稳如磐石

创新药开发“九死一生”,能成功从靶点筛选走到商业化落地的产品实属凤毛麟角。在布满荆棘的血液学领域,罗氏又为何能不断推陈出新,屹立于潮头之巅二十多年不倒?Peter分享了他的真知灼见。
首先,罗氏在血液学领域不是盲目地扩张,而是始终以患者和市场的未尽之需为导向,有的放矢地进行科学规划和资源整合,拓宽DLBCL、MM、血友病A和PNH等重点细分疾病领域的治疗版图。这是罗氏能够鹤立鸡群成为行业领先者和保持创新地位的核心要素。
其次,“从未满足的治疗需求出发,我们努力成为开拓者,去无人区探索。就创新而言,我们试图做到独一无二,而不是重复前人所做的事情。” 在紧贴需求的基础上,罗氏将创新基因深深融合在差异化管线迭代中,通过多样的药物类型和前沿的技术平台进行不同的新靶点组合碰撞,采用皮下注射或固定疗程等给药模式持续改善患者的治疗体验,最终为其创造更多的“治愈”机会。
罗氏血液领域主要产品管线
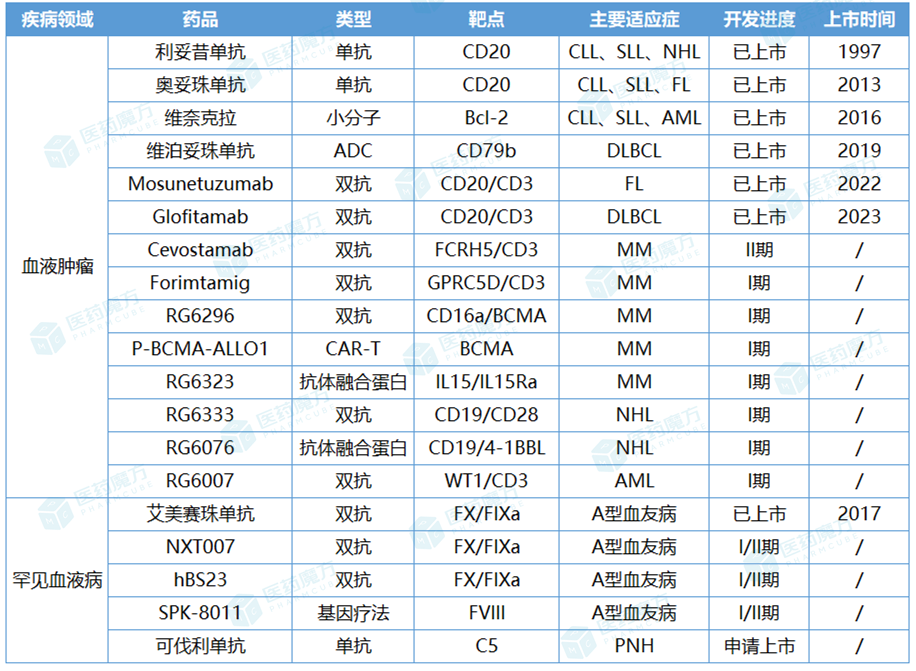
尤其是双抗赛道,罗氏依靠前瞻的布局建立起强劲的竞争优势。据不完全统计,罗氏在血液学领域部署的主要双抗资产已达到10款之多。从全球双抗市场格局来看,艾美赛珠单抗虽然针对的是罕见病,但却是目前销售额最高的双抗药物,2022年以38.28亿瑞士法郎(约40.07亿美元)攫取了全球双抗市场的最大份额。
此外,罗氏作为创新者,非常看重研发投入并在逐年增加其投入规模,这也是罗氏屡获成功的重要因素。任何一款创新药的问世都离不开真金白银的投入,十亿美金、十年周期的“双十定律”已成共识。从某种程度上,研发费用的多少也折创新水平的高低。近10年来,罗氏几乎蝉联全球药企研发投入排位榜TOP1。2022年,罗氏的研发投入再创记录达140.53亿瑞士法郎(折合约近150亿美元),占据总营收约为22%的比重。值得一提的是,罗氏还在美国、欧洲和中国分别设立了3个全球独立的研发中心。
“罗氏保持成功的一个关键是对于人才的重视。” Peter Ahnesorg补充道,“我们非常自豪的一件事是,在上海坐落着罗氏全球三大研发中心之一,而在北京等地我们都设有办公室。因此,可以吸引中国的人才加入我们,帮助我们实现药物的全球开发和创新,这对我们的成功至关重要。”
本文作者可以追加内容哦 !

