
6月21日,Argenx宣布FDA已批准艾加莫德皮下注射液(VYVGART Hytrulo)用于乙酰胆碱受体(AChR)抗体阳性的全身型重症肌无力(gMG)成人患者的生物制品许可申请(BLA)。

艾加莫德皮下注射与重组人透明质酸酶PH20(rHuPH20)共同配制,使用Halozyme的ENHANZE药物递送技术。ENHANZE技术促进了通常通过静脉输注给药的生物制剂的皮下注射给药。
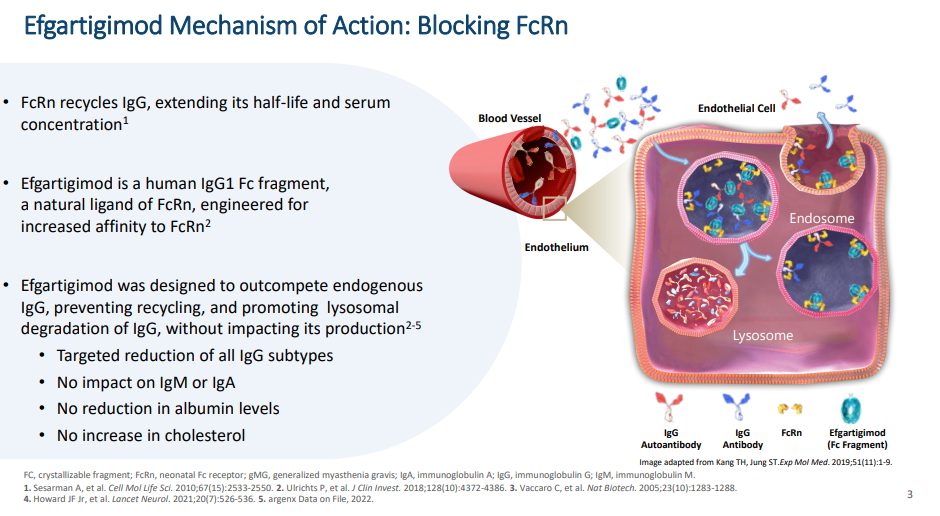
本次上市申请是基于III期ADAPT-SC研究的积极数据,该研究评估了艾加莫德皮下注射与艾加莫德静脉输注在gMG成人患者中的药效学非劣效性。该研究达到了主要研究终点(p<0.0001),即基线水平相比,艾加莫德皮下注射在第29天表现出平均总IgG减少66.4%,而艾加莫德静脉输注为62.2%。
安全性方面,患者总体耐受性良好,最常见的不良事件是注射部位反应(ISR)。所有ISR均为轻度至中度,并随着时间的推移而消失。
ADAPT-SC研究完成后,95%患者将进入ADAPT-SC+研究,这是一项为期三年的开放标签扩展研究,旨在评估艾加莫德皮下注射的长期安全性和耐受性。
2021年12月,艾加莫德静脉注射液首次获FDA批准用于治疗于成人gMG。艾加莫德是首个也是目前唯一在美国、欧洲和日本获批用于成人gMG治疗的FcRn拮抗剂。值得一提的是,再鼎医药已与argenx达成独家授权合作,在大中华区开发和商业化艾加莫德。此外,再鼎医药向NMPA递交的艾加莫德静脉注射液用于治疗成人gMG的上市申请已于2022年7月获得受理。
Copyright 2023 PHARMCUBE. All Rights Reserved. 欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。 免责申明:本微信文章中的信息仅供一般参考之用,不可直接作为决策内容,医药魔方不对任何主体因使用本文内容而导致的任何损失承担责任。精彩预告
追加内容
本文作者可以追加内容哦 !

