11月21日,先声药业和香港康乃德生物医药宣布双方就创新药IL-4R单抗Rademikibart订立独家许可与合作协议。

根据协议,康乃德将获得 1.5 亿人民币(约合 2100 万美元)的预付款,在实现特定的开发和商业里程碑后将获得高达 8.75 亿人民币(约合 1.2 亿美元)的付款,此外还将获得高达净销售额两位数百分比的特许权使用费。
先声药业集团将获得在大中华地区开发、生产和商业化该产品所有适应症的独家权利。
康乃德生物医药将保留该产品在协议地区以外的权利,并将继续完成在中国正在进行的特应性皮炎(AD)临床试验,按计划于 2024 年第一季度末提交 AD 在中国的新药申请。
先声药业将负责rademikibart在中国的AD新药申请,还将负责大中华区新适应症的开发并承担相关费用。
先声药业表示:此次Rademikibart的独家许可与合作,将进一步丰富其在自身免疫领域的产品布局,加强自身免疫领域商业化协同效应。

Rademikibart 是靶向IL-4R 的全人源单抗,IL-4R是IL-4R受体和 IL-13 受体的共同亚基。Rademikibart 能与 IL-4R 中一个独特的区域结合,阻止受体与其他受体亚基相互作用,从而治疗特应性皮炎,哮喘等Th2介导的疾病。
康乃德表示,Rademikibart差异化优势在于以方便的给药频率快速起效并持续改善临床疗效的潜力。该药有望采用每4周一次的给药方式。

目前Rademikibart正在开展AD和哮喘的临床试验。
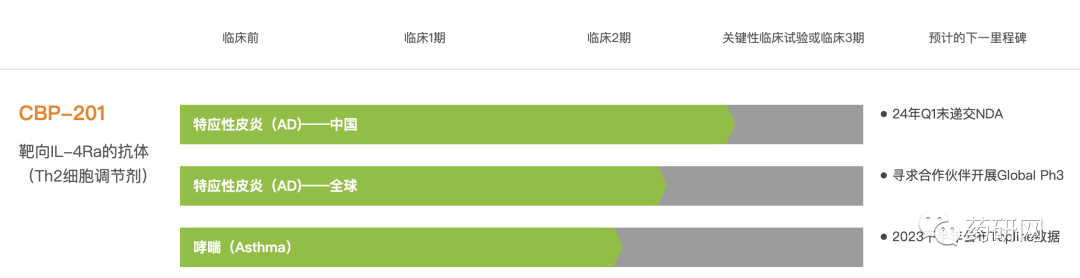
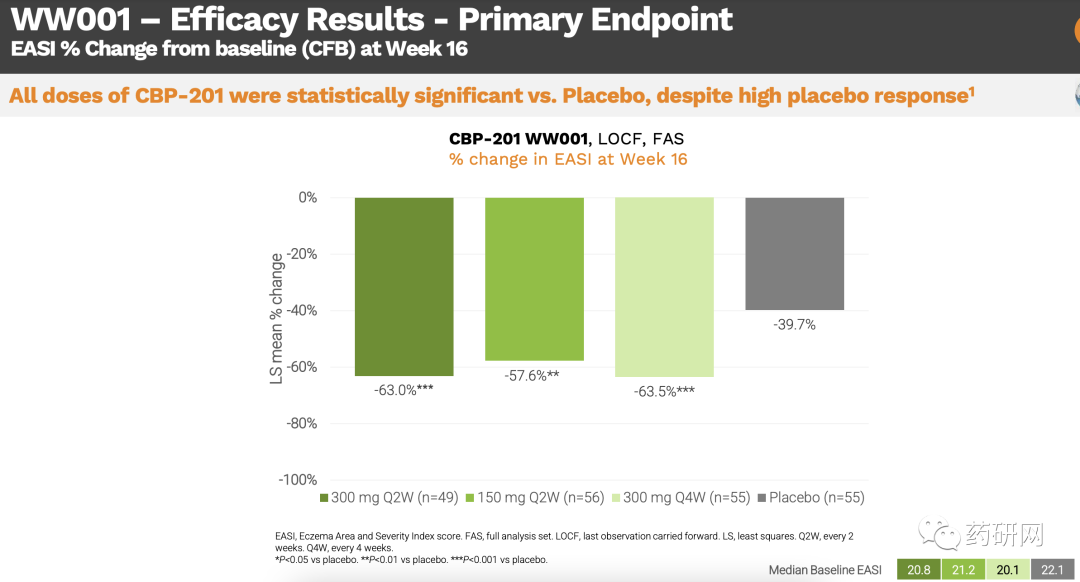
中重度AD成人患者的2b期全球临床试验结果显示,所有三个剂量的CBP-201 治疗组(300mg Q2W, 150mg Q2W或300mg Q4W)在第16周时均达到了主要有效终点。
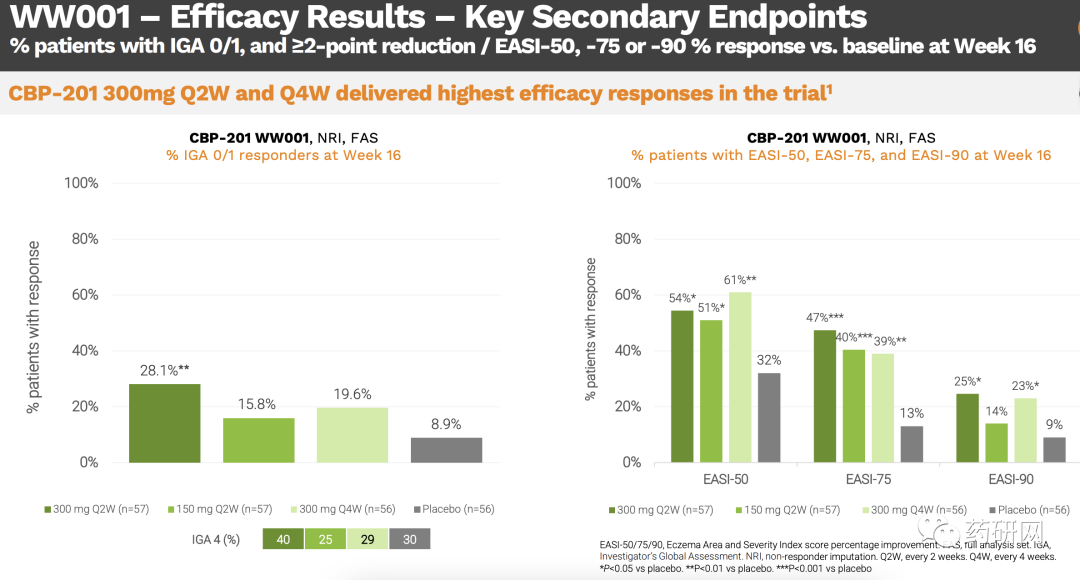
安全性良好,治疗中出现的不良事件、严重不良事件和导致研究药物中断的TEAEs的发生率,在CBP-201治疗组和安慰剂组相似。而且,在接受CBP-201的患者中,注射部位反应发生率(1.8%)、结膜炎发生率(3.5%)和疱疹病毒感染发生率(0.6%)都很低。
康乃德表示,基于2b期试验的结果,有望实现CBP-201在疗效和安全性方面以及更方便的每四周一次差异化给药方式上的竞争潜力。
但此消息公布后,康乃德股价大跌。
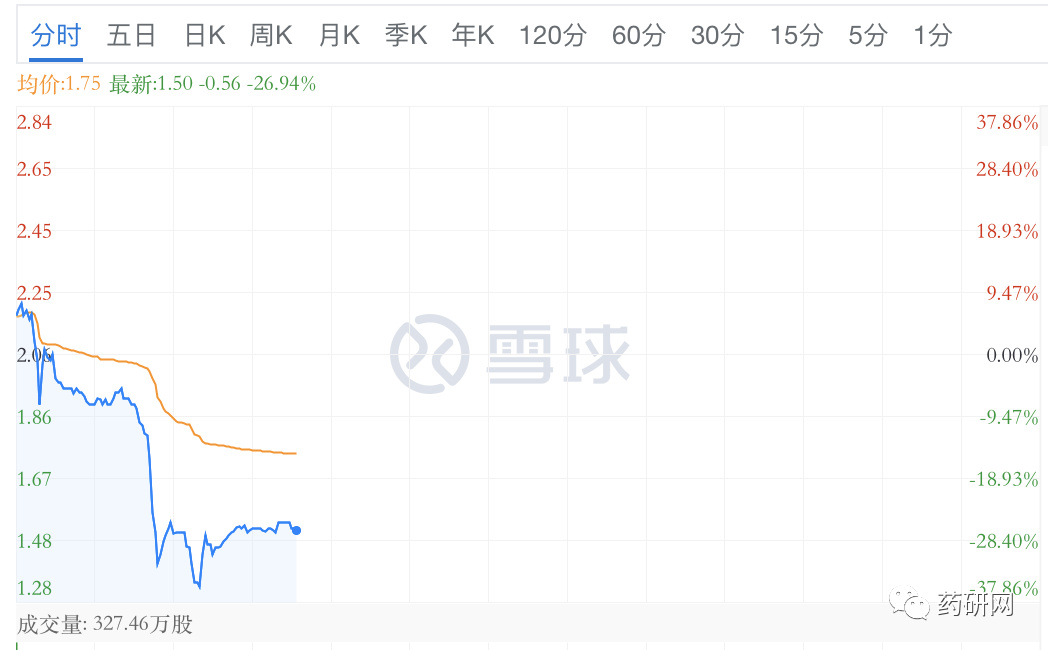
目前IL-4/IL-13领域最先上市的是赛诺菲/再生元共同开发的IL-4R单抗Dupilumab,在AD、哮喘和CSwNP等疾病中具有显著的临床疗效。今年上半年销售额49亿欧元,全年有望突破百亿。
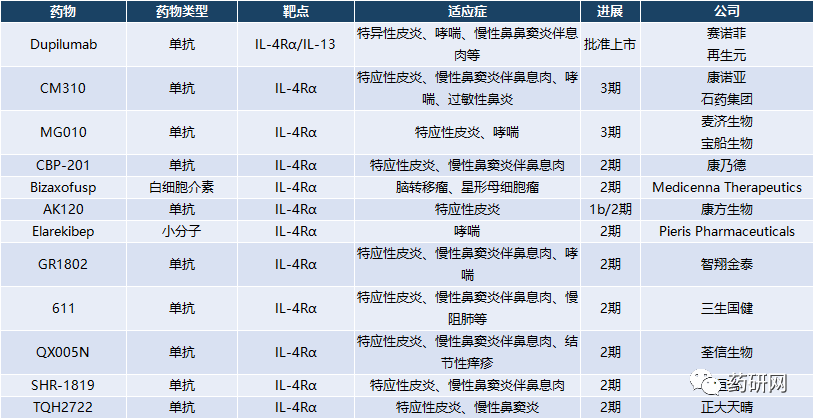
此外,国内多个企业都有所布局。
关注wechat药研网
本文作者可以追加内容哦 !

