
在当今生命科学与医疗技术迅猛发展的浪潮中,细胞基因疗法(Cell & Gene Therapy,CGT)作为前沿的医疗技术,正以其独特的治疗机制和显著的治疗效果,逐渐成为医药领域的新宠。随着政策的不断完善和技术的持续进步,CGT正加速推动着新药研发的进程,开启了一个治疗难治性疾病的新纪元。
本文基于药融咨询最新发布的《CGT产业现状与未来趋势蓝皮书》节选内容,旨在深入探讨CGT技术的优势、发展历程以及政策环境对其发展的推动作用,以期为读者提供关于CGT领域的全面了解和深入思考。
《CGT产业现状与未来趋势蓝皮书》综合了最新的研究成果与行业动态,力图呈现CGT这一新兴领域的发展全貌,为行业内外提供一份权威、前瞻性的观察视角,也为政策制定者、科研人员及投资者们提供决策参考和洞见。
一、CGT的定义与分类
细胞基因疗法(Gene & Cell Therapy,简称 GCT/CGT)指将确定的遗传物质转移至患者的特定靶细胞内,通过基因添加、基因修正、基因沉默等方式修饰个体基因的表达或修复异常基因,达到治愈疾病目的的过程。
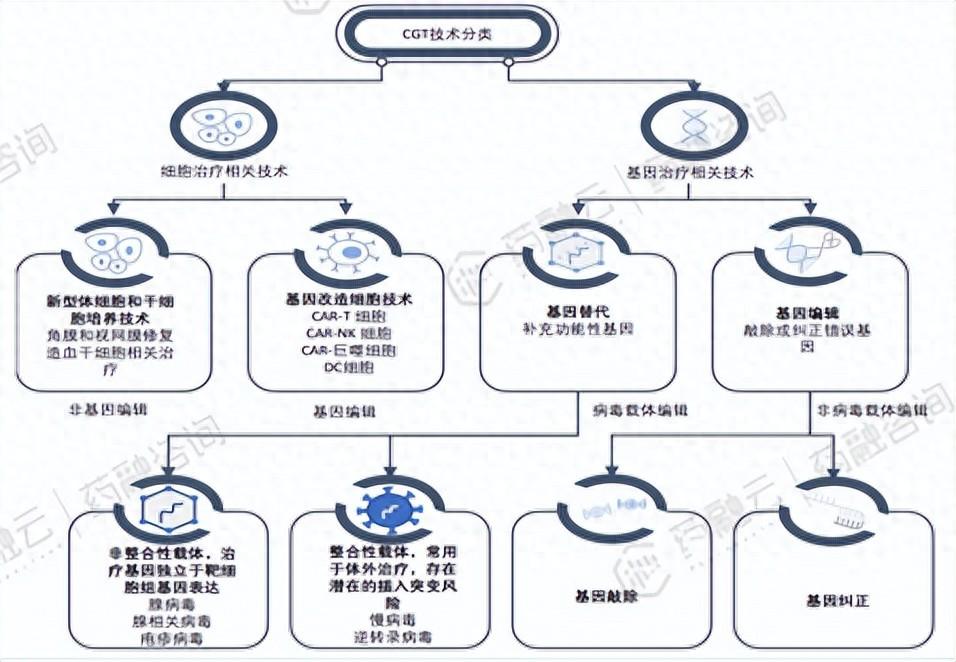
CGT分为细胞疗法和基因疗法。细胞疗法(体外治疗):干细胞疗法和细胞免疫疗法,后者又可分为过继细胞疗法(ACT)、肿瘤疫苗等。ACT包括嵌合抗原受体T细胞(CAR-T)疗法、T细胞受体嵌合型T细胞(TCR-T)疗法、嵌合抗原受体自然杀伤细胞(CAR-NK)疗法、肿瘤浸润淋巴细胞(TIL)疗法等。
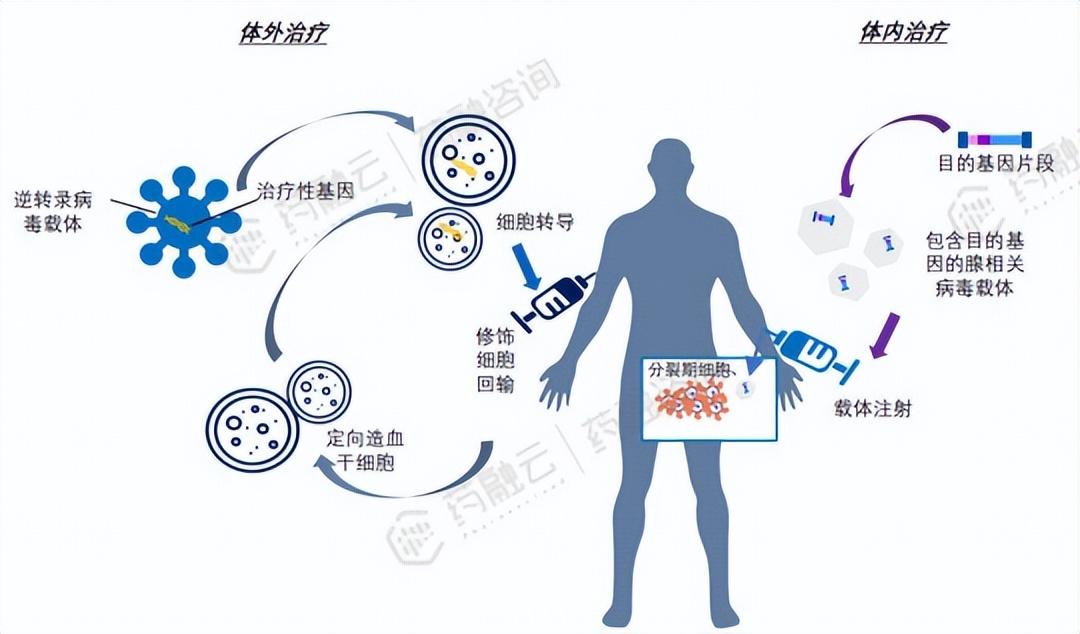
基因治疗(体内治疗):基因疗法(按照递送载体分为病毒载体和非病毒载体递送系统)、溶瘤病毒(OV)疗法、RNA干扰(siRNA,ASO)疗法。根据目的基因的作用机理可分为治疗型(例如核酸药物)和预防型(mRNA疫苗,DNA疫苗)以及预防和治疗兼顾型(个性化新抗原基因免疫)。
二、CGT的优势分析
在广阔的生物医药领域,人类基因编码的功能性蛋白数量超过20000种,这些蛋白在生命活动中扮演着至关重要的角色。目前,全球新药研发靶点的总数已达到7042个,这些靶点涵盖了从肿瘤治疗到罕见病用药等多个领域,展现了生物医药研究的广泛性和深度。
然而,尽管全球新药研发靶点数量庞大,但真正能够成功转化为批准上市新药的靶点却相对较少。据药融云数据统计,全球批准上市的新药靶点数量仅为912个,占总数量的不到5%。
1. 突破“难以成药” 束缚,提高研发成功率
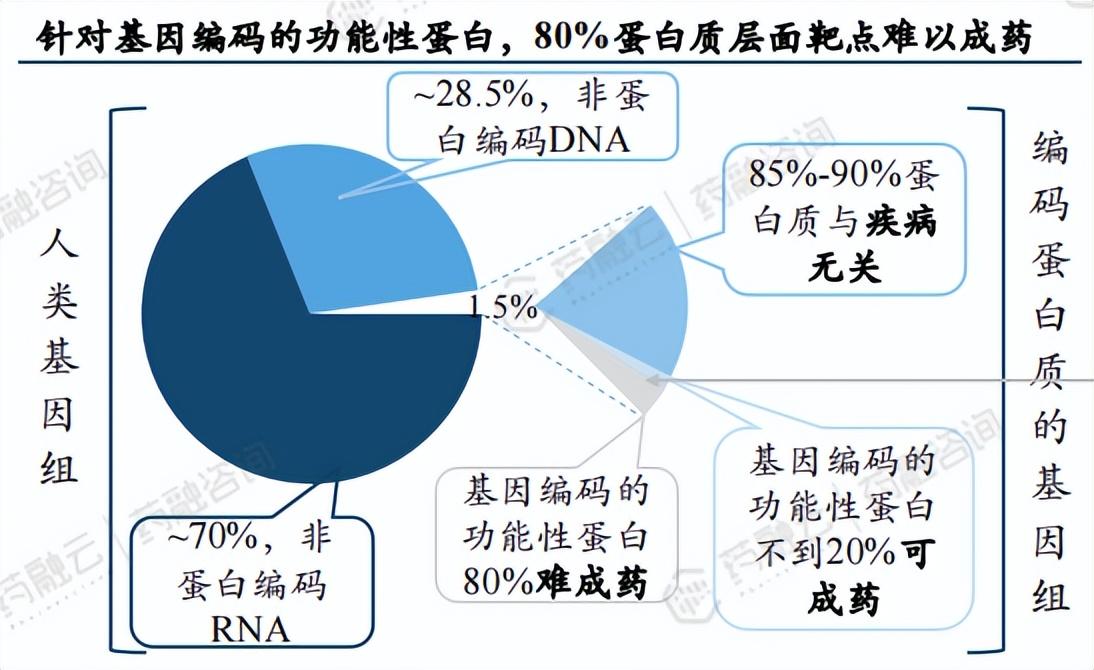
相比于小分子靶向药和生物药,CGT药物直接靶向DNA发挥作用,作用机制明确,打破蛋白质层面靶点难以成药魔咒,潜力巨大。根据Nature Reviews Drug Discovery 披露,蛋白质编码基因仅占整个人类基因组的约1.5%,其中和疾病无关的蛋白质占其中的85%~90%。同时,在10%-15%与疾病相关的致病蛋白中,超过80%的蛋白质不能被目前常规的小分子药物以及生物大分子制剂所靶向,属于不可成药蛋白质靶点。
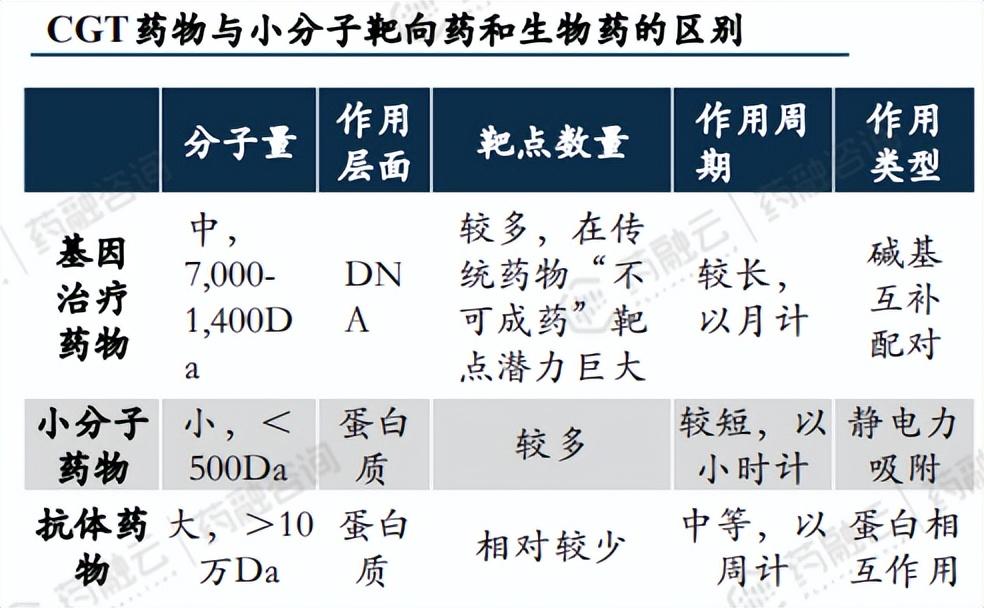
2. CGT药物与小分子靶向药和生物药的区别
CGT药物、小分子靶向药和生物药在分子量、作用层面、靶点数量、作用周期和作用类型等方面均存在显著的区别。这些区别反映了它们在生物医药领域中的不同应用和发展方向。
3. CGT药物作用机制明确,临床成功率高
CGT药物因其明确的作用机制而备受瞩目,并在临床上取得了显著的成功。尽管CAR-T(嵌合抗原受体T细胞)和RNAi(RNA干扰)技术的复杂性有所增加,但这并未妨碍它们在药物研发上的优势。这两种疗法药物作用的靶点更加清晰,作用机制也更为明确,由此使得其临床疗效(LOA)也大大提高。
据美国生物技术创新组织机构(BIO)发布的2011-2020年临床研发成功率数据,CAR-T疗法从临床I期到最终获批上市的成功率高达约17%,在所有疗法中位居榜首。紧随其后的是RNAi疗法,其成功率为13.5%,同样表现出色。而基因治疗领域的整体成功率也达到了10%,虽然略低于单抗类药物的12%,但明显高于小分子药物的7.5%。这些数据不仅验证了CAR-T和RNAi技术的强大潜力,也进一步证明了CGT药物在药物研发领域的重要地位。

三、CGT的发展历程
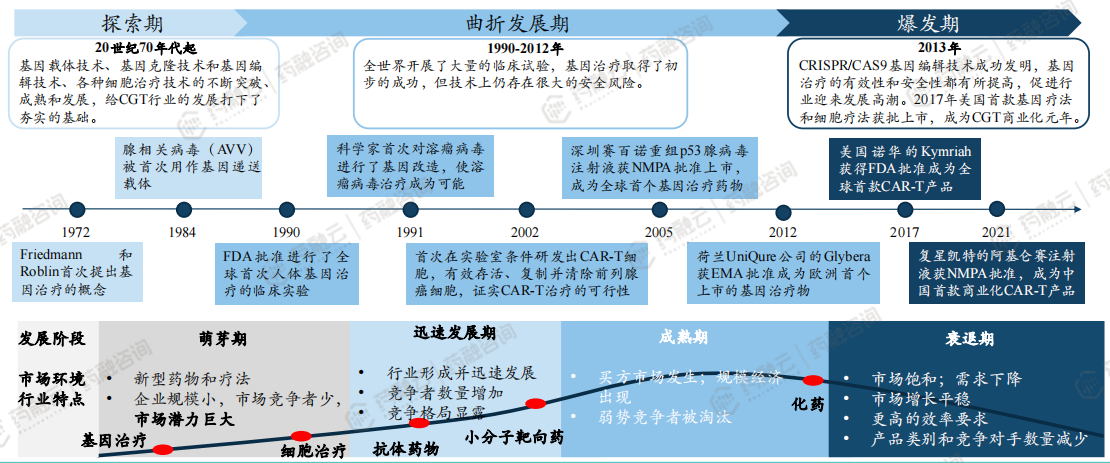
尽管CGT概念提出至今已有半个多世纪,但相较于化学药物和生物靶向药,其发展仍处于萌芽期。从最初的探索,经历曲折发展,再到近年来的技术爆发,CGT的每一步都伴随着科研人员的不懈努力与技术革新。尤其是近十年,随着基因编辑技术的成熟和应用,CGT进入了一个全新的发展阶段。
1. 探索期(20世纪60-80年代)
基因载体技术、基因克隆技术和基因编辑技术、各种细胞治疗技术的不断突破、成熟和发展,给CGT行业的发展打下了夯实的基础。细胞与基因治疗的概念最早可追溯到20世纪60年代,当时科学家们开始探索将基因片段直接引入细胞以改变其遗传特性的可能性。
1970年代,首次成功的DNA重组实验标志着基因工程时代的到来,为基因治疗奠定了基础。1980年代,科学家首次尝试使用病毒载体将基因导入人体细胞,这是基因治疗早期的重要尝试,尽管初期实验充满挑战,但为后续的研究奠定了基础。
2. 曲折发展期(1990-2012年)
全世界开展了大量的临床试验,基因治疗取得了初步的成功,但技术上仍存在很大的安全风险。1990年,美国进行了全球首例以逆转录病毒为载体的基因治疗临床试验,标志着基因治疗正式进入临床实践阶段。
1991年,科学家首次对溶瘤病毒进行了基因改造,使溶瘤病毒治疗成为可能。2002年,首次在实验室条件研发出CAR-T细胞,有效存活、复制并清除前列腺癌细胞,证实CAR-T治疗的可行性。2005年,深圳赛百诺重组p53腺病毒注射液获NMPA批准上市,成为全球首个基因治疗药物。2012年,荷兰UniQure公司的Glybera获EMA批准成为欧洲首个上市的基因治疗物。
3. 爆发与成熟期(2010年代末至今)
2013年,CRISPR/CAS9基因编辑技术成功发明,基因治疗的有效性和安全性都有所提高,促进行业迎来发展高潮。2017年,美国诺华的Kymriah获得FDA批准成为全球首款CAR-T产品,成为CGT商业化元年。2021年,复星凯特的阿基仑赛注射液获NMPA批准,成为中国首款商业化CAR-T产品。
这一时期,基因编辑技术如CRISPR-Cas9的出现,使基因治疗的精确性和效率得到大幅提升,为治疗遗传性疾病提供了前所未有的可能性。各国政府和监管机构也纷纷出台政策支持CGT的发展,加快了新药的研发与上市流程。
药融云数据库显示,截止目前,全球已有超70款CGT品种上市。中国在CGT领域也取得了显著进展,国内CGT在研管线647余项,除上市8款外,申请上市3项,Ⅰ期临床295项,Ⅱ期临床217项,Ⅲ期临床20项,申请临床54项。据悉,2016-2020年,全球CGT市场规模年复合增长率达153.3%,2020年为20.75亿美元。预计到2025年,市场规模有望达到305.39亿美元。
四、CGT的政策环境
中国细胞基因治疗(CGT)政策的发展经历了从自由发展到调整,再到规范化的三个重要阶段,每个阶段都对应着不同的政策背景、特点和主要内容。

1. 自由发展阶段(约1990年代至2015年)
这一阶段,中国的CGT研究和产业发展尚处于起步阶段,相应的政策环境较为宽松,监管政策和法规相对滞后。
主要特征包括:
(1)监管政策简略:当时的政策法规对CGT研究开发的各个环节缺乏详细的规定和指导,法规的约束力较弱,审批流程相对宽松,为创新研究提供了较大的探索空间。
(2)鼓励探索:国家层面虽然没有专门的CGT政策,但总体上鼓励生物医药领域的创新和技术引进,为CGT的初步探索提供了宏观环境上的支持。
(3)监管机构设置:随着生物技术的发展,相关监管机构开始逐步设立和完善,如国家食品药品监督管理局(SFDA,现为国家药品监督管理局NMPA)等,但针对CGT的具体监管框架尚在形成中。
2. 调整阶段(约2015年至2019年)
这一阶段,随着国内外CGT研究的快速发展和一些安全性事件的发生,中国开始对CGT的监管政策进行调整,加强监管力度,确保患者安全。
(1)“魏则西”事件影响:2016年的“魏则西事件”引发了社会对细胞治疗安全性与伦理问题的广泛讨论,促使政府加强了对生物安全、基因技术的立法工作,开始收紧监管。
(2)政策出台与修订:国家相关部门开始制定和修订相关政策,包括《关于调整部分医疗器械行政审批事项审批程序的决定》等,对基因测序、细胞治疗等进行更严格的监管。
(3)伦理审查强化:加强了对临床试验的伦理审查,确保研究遵循国际伦理标准,保护受试者的权益。
3. 规范化发展阶段(2019年至今)
随着CGT技术的不断成熟和行业的快速发展,中国进入了一个更加规范化的发展阶段,政策趋于完善,旨在加速新药研发和技术创新,同时保障安全性。
(1)政策支持与规划:国家发布了一系列政策文件,如《关于促进生物医药产业园区高质量发展的指导意见》等,明确支持CGT在内的生物医药创新发展,鼓励新药研发和开展生物技术创新。
(2)监管体系完善:NMPA对CGT的审评审批流程进行了优化,建立了更为科学高效的监管体系,包括特殊审批通道、优先审评等机制,加快了创新产品的上市速度。
(3)质量与安全监管:加大对CGT产品的质量控制和生产过程的监管,确保产品质量和生产合规,同时推动行业标准和评价方法的建立和完善。
(4)国际合作:鼓励和支持CGT领域的国际合作,参与国际规则的制定,促进技术交流和资源共享,提升中国在全球CGT领域的影响力。
结语:
CGT凭借其独特的优势和不断完善的政策环境,正在全球范围内引领新药研发的新趋势。未来,随着技术的不断成熟和政策的进一步优化,CGT有望为更多难治性疾病患者带来革命性的治疗方案,开启精准医疗的新篇章。
<END>
本文作者可以追加内容哦 !

