7月2日,礼来宣布新一代抗A单抗Donanemab获FDA批准上市,商品名为Kisunla,用于治疗早期症状性阿尔茨海默病(AD),包括AD所致的轻度认知障碍以及轻度AD。Kisunla是首个有证据表明在淀粉样斑块清除后可停止治疗的淀粉样斑块靶向疗法。

6月10日,礼来研发的一款治疗AD的药物Donanemab,经FDA外周和中枢神经系统药物咨询委员会(PCNS)审核后,以11:0的投票结果认定该产品获益大于风险,并同意礼来后续递交产品的其他资料。11:0 ! FDA咨询委员会全票支持礼来阿尔茨海默症药物新药Donanemab,批准在望!
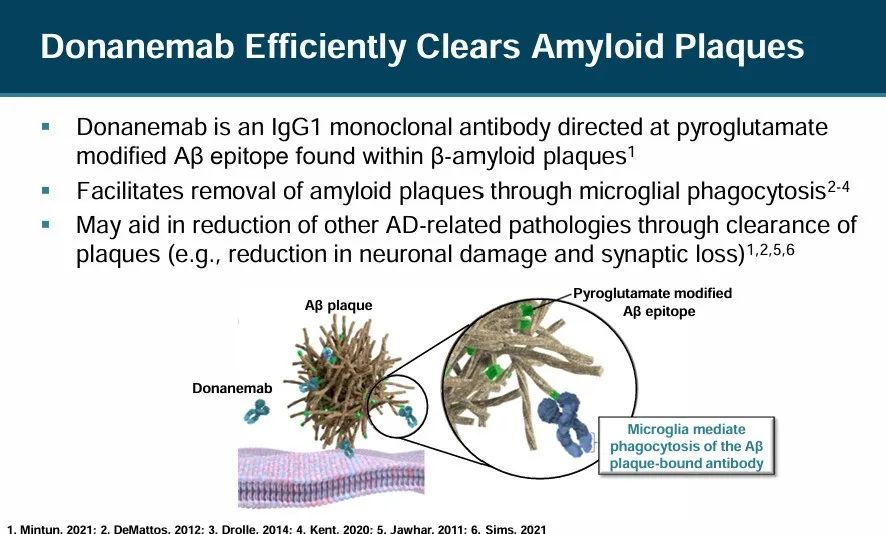
Donanemab是一款针对AD病理蛋白(A蛋白)的IgG1单克隆抗体,能够与AD患者大脑中沉积中的A结合,从而促进患者大脑中致病蛋白的清除,改善患者症状,减缓疾病进展。
Donanemab治疗早期症状性阿尔茨海默病的TRAILBLAZER-ALZ 2是一项随机、双盲、安慰剂对照的III期临床试验,评估了该药物在60-85岁早期症状性阿尔茨海默病患者中的安全性和有效性,共入组了1736患有早期症状性阿尔茨海默病以及类淀粉蛋白和tau病理的参与者,按照其tau水平,分为低-中等tau组或高tau组(疾病进展的后期病理阶段)。
在 donanemab 的关键 3 期试验中,tau 水平低至中度的患者似乎获得了最大获益。根据 iADRS(综合阿尔茨海默病评定量表)的衡量病情减缓了35%, 根据 CDR-SB(临床痴呆评定量表-总计分)的传统评价表病情减缓了36%。(见下图),研究结果显示,该药物显著减缓了认知能力的下降。
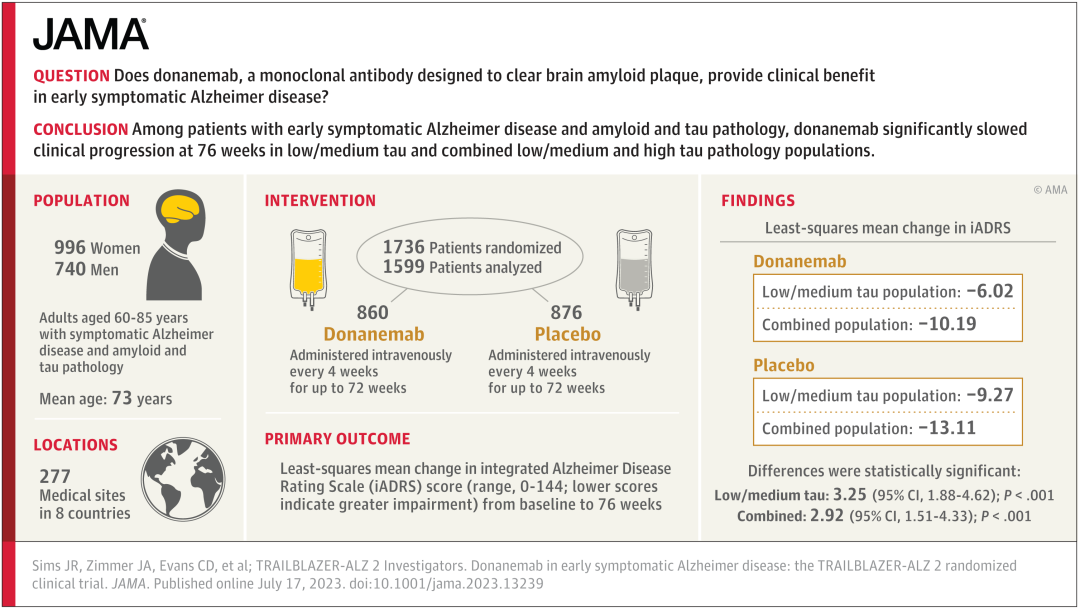
TRAILBLAZER-ALZ 2试验设计与结果摘要
安全性方面,donanemab淀粉样蛋白相关成像异常 (ARIA),24%的患者出现脑肿胀,31.4% 的患者出现脑微出血,高于卫材/Biogen的Leqembi的12.6%和17.3%的发生率。
目前,礼来给的药物的定价为695.65美元/瓶。不过,由于TRAILBLAZER-ALZ 2研究在第6个月、第12个月和第18个月时分别有17%、47%和49%患者达到治疗目标(淀粉样斑块水平降低至最低水平)且可以停药,因此Ddonanemab的总治疗费用也会因人群而异。

按照此定价计算,患者治疗6周的费用大约1.25万美元,治疗一年的费用大约3.2万美元,而渤健A抗体的年度治疗费用是2.65万美元。Donanemab后续将与卫材/Biogen已上市的Leqembi直接竞争。
本文作者可以追加内容哦 !

