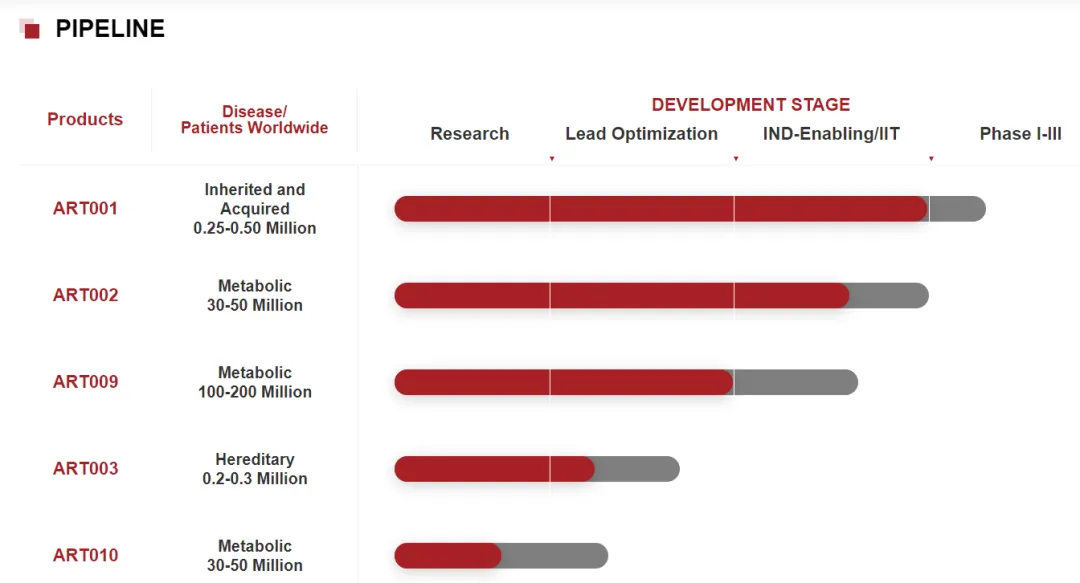
7月22日,CDE官网最新公示显示,锐正基因(Accuredit)申报的1类新药ART001注射液获批临床,拟开发治疗转甲状腺素蛋白淀粉样变性(ATTR)。
据锐正基因新闻稿,ART001是中国首个进入人体临床研究(IIT)的非病毒载体体内基因编辑药物。
今年6月,锐正基因公布了该产品治疗ATTR患者的研究者发起的临床研究(IIT)数据。ART001通过24周临床安全性和药效观察,展现出了优异的安全性与药效。给药后4周,高剂量组受试者外周TTR蛋白较基线即可平均下降90%以上;给药24周后,高剂量组受试者ART001药效稳定在90%以上,并初步显示出一次性给药即可获得长期持续药效的潜力。

ART001注射液由锐正基因研发,通过脂质纳米颗粒(LNP)将CRISPR基因组编辑组件递送到肝脏,对TTR基因进行编辑,从而阻断TTR蛋白的表达,从根源上避免产生淀粉样物质异常沉积。
由于体内基因编辑药物有潜力终生只需用药一次即可停止病情进展甚至逆转和”治愈“疾病,有望为ATTR患者带来新的治疗方法。此外,据锐正基因公开资料介绍,该公司开发的体内基因技术平台以脂质纳米颗粒(LNP)作为递送载体,不需使用病毒和细胞,因此可大大节省成本。

ATTR是一种致死性罕见疾病,发病原理是由于转甲状腺素蛋白(TTR)四聚体不稳定导致单体异常折叠,形成了淀粉样沉积。这些淀粉样纤维在血液循环中逐渐沉积于人体多个组织器官,尤其是心脏及神经系统,严重影响患者的生命质量。
此前ART001于2023年IIT中启动了人体临床研究,截至2024年5月,所有10例受试者均已完成至少24周随访。最长已经给药近10个月。10例受试者未发生输注相关反应(IRR),未发生与药物相关的严重不良事件(SAE)或严重不良反应(SAR),也未见肝毒性和免疫毒性。在基因编辑产品最令人关注的脱靶编辑方面,ART001在人体细胞实验中,即使超过饱和剂量近80倍,都检测不到任何脱靶编辑。
锐正基因创始人、董事长兼首席执行官王永忠博士表示:"非常高兴ART001能获得CDE的临床批准,这将有力地推进ART001的快速开发。我们会继续努力,争取早日给众多的ATTR患者带来福音。"
据悉,ART001还将于近期申报美国(FDA)IND,有潜力成为中国乃至全球第一个进行中美双报的非病毒载体体内基因编辑药物。
锐正基因(苏州)有限公司成立于2021年7月,专注于全球领先的非病毒载体基因编辑技术和产品的开发与商业化,用于治疗严重或危及生命的遗传性和获得性疾病。
2021年9月,锐正基因宣布完成数千万美元的种子轮融资,由君联资本领投。该公司在研管线中还有其它几款用于治疗代谢病和遗传性疾病的在研产品。
本文作者可以追加内容哦 !

