7月30日,上海市人民政府召开发布会,解读刚刚出台的支持生物医药产业全链条创新发展的若干意见。
意见共三十七条内容,覆盖大力提升创新策源能力、推动临床资源更好赋能产业发展、推动审评审批进一步提速、加快创新产品应用推广、加强为企服务和产业化落地支持、强化投融资支持、释放数据要素资源价值、推动产业国际化发展等方面。
真金白银的补贴支持。
比如大力提升创新策源能力部分提到,持续加大创新药研发支持力度:对上海市的注册申请人开展国内Ⅰ期、Ⅱ期、Ⅲ期临床试验并实现产出的1类新药,按照规定对不同阶段择优给予不超过研发投入的40%,最高分别1000万元、2000万元、3000万元支持;对其中仅需完成早期临床试验、确证性临床试验的细胞与基因治疗1类新药,按照规定择优给予最高分别1500万元、3000万元支持。每个单位每年累计支持金额最高1亿元。
在加快创新产品应用推广方面,意见提到,鼓励创新产品入院配备使用。在国家医保药品和“新优药械”产品更新发布1个月内,上海市的医院对创新药械“应配尽配”。
意见还提出要加大创新产品医保支付支持力度。对于国家医保谈判药品和创新医疗器械涉及的诊疗项目,实行医保预算单列支付、在DRG/DIP改革中单独支付;对符合条件的高价值创新医疗器械、创新医疗服务项目,在DRG/DIP改革中独立成组、提高支付标准、不受高倍率病例数限制。对符合规定的“新优药械”产品,及时研究纳入医保支付范围。
上述支持政策意自2024年8月1日起实施。

港资回补

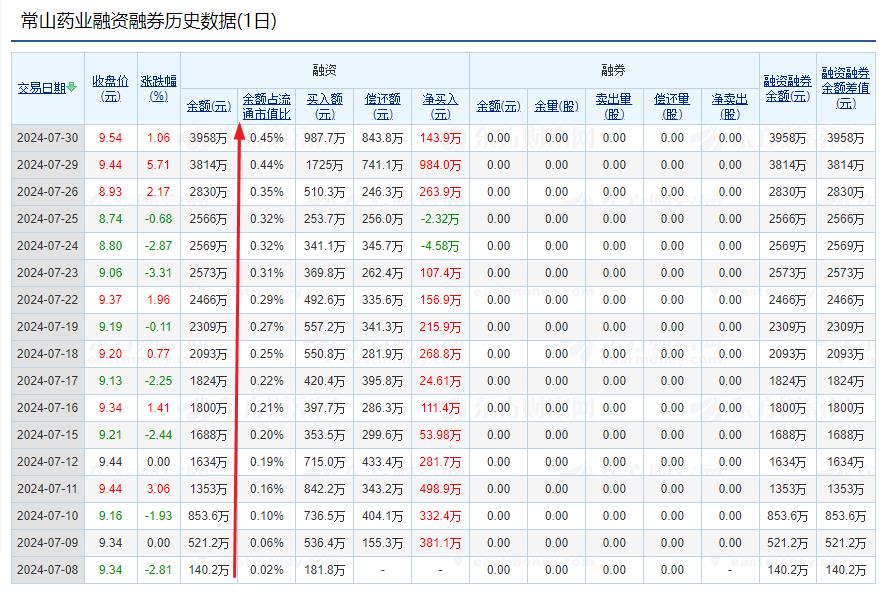
天天融资买入,未到4000万元。
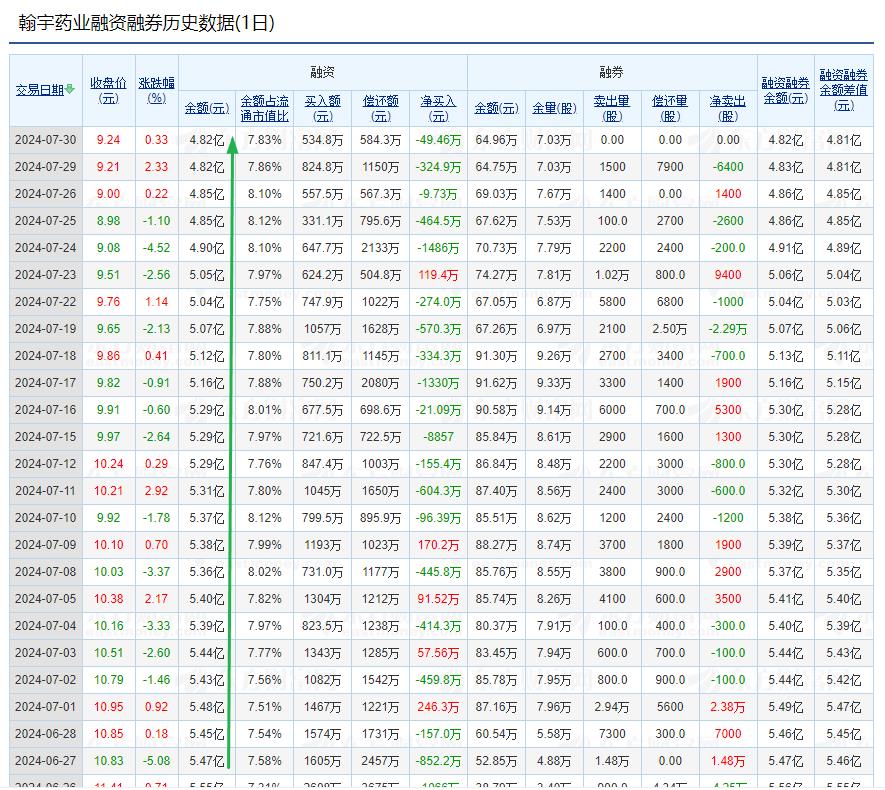
何时达翰宇药业融资4-5亿元?
NDA是New Drug Application 的缩写,是指新药经过临床试验后,申报注册上市的阶段。创新药物的产生需要经历五个阶段,分别是制备化合物阶段、临床前研究、临床研究、上市注册、新药监测。在临床研究后,药品上市前还有临门一脚,就是按照要求准备材料,进行注册上市申报(NDA申报)。经过NDA申报,药品获得批准后才能上市销售。
试点方案中,最受关注的是两个“加速度”:一是药审中心在受理试点项目的临床试验申请后,将在30个工作日内完成审评审批,并通过药审中心网站通知申请人审批结果。二是申请人与试点机构开展高效合作,于临床试验申请获批后12周内启动临床试验(第一例受试者签署知情同意书)。
2023年度创新药获准上市所用时间平均为7.2年。如何压缩临床试验启动整体用时、加快临床试验审评审批进展,成为了提升创新药研发效率、降低研发成本、助推创新药较快上市的关键一环。
本文作者可以追加内容哦 !

