8月2日,国家药品监督管理局发布批复称,经审核,同意在北京、上海开展优化创新药临床试验审评审批试点。据悉,这也是7月31日优化创新药临床试验审评审批试点工作方案印发以来,公布的首批试点区域。
7月31日,国家药监局印发优化创新药临床试验审评审批试点工作方案。该方案提出,优化创新药临床试验审评审批机制,强化药物临床试验申请人(简称“申请人”)主体责任,提升药物临床试验相关方对创新药临床试验的风险识别和管理能力,探索建立全面提升药物临床试验质量和效率的工作制度和机制,实现30个工作日内完成创新药临床试验申请审评审批,缩短药物临床试验启动用时。
“这一政策对于上海的创新药公司而言,无疑是重大利好。首先,审评审批时间大幅缩短,将显著加快创新药临床试验的进程,降低时间成本,提高研发效率。”箕星药业首席执行官牟艳萍告诉记者,这意味着公司能够更快地获得临床试验的许可,更早地开展关键的临床研究,加速药物研发的整体进度。同时也有助于减少研发过程中的不确定性和风险,为公司的创新药研发提供更稳定和可预测的环境。
王刚解释道:“30个工作日内完成临床试验申请的审评审批这一决策,基本对标国际,目前美国FDA(美国食品药品监督管理局)是30个自然日完成审批,这有助于人力、物力、财力等资源的节约和效率的提升。”
和铂医药产品开发事业部总裁陶晓路认为,缩短审批审评周期至30个工作日,将显著缩短新药从研发到临床试验乃至上市的整个流程,有助于加速新药上市进程。资金更快的回收和再利用可以形成一个良性循环,促进整个创新药行业的快速发展。
“时间对于创新药研发至关重要,缩短审评审批时间,减少了企业在等待审批结果期间的不确定性和成本投入,有助于企业更好地控制研发成本,同时也有助于企业及时获取药物疗效和安全性的反馈,从而及时调整研发策略,提高新药研发的成功率,增强市场竞争力。”陶晓路表示。
根据方案,此次试点工作实施步骤包括,试点区域申请、试点机构申请、试点项目申请、审评审批、启动实施药物临床试验。此次国家药监局将北京、上海纳入首批优化创新药临床试验审评审批试点,是开启试点工作的第一步。
其中,北京、上海的试点工作为期一年,在试点期间,两地需要至少完成10个品种的临床试验申请审评审批并启动临床试验,并将在2025年1月开展中期评估,2025年7月总结试点工作经验。
与此同时,方案明确提出,此次试点项目范围为1类创新药(细胞和基因治疗产品、疫苗产品等除外)临床试验申请。申请人不受区域限制,需在境内外至少获批过3个创新药临床试验申请,有丰富的临床试验实施及药物警戒管理经验,能够在临床试验申请提交前对临床试验项目进行全面的风险评估并制定有效的风险管理计划。
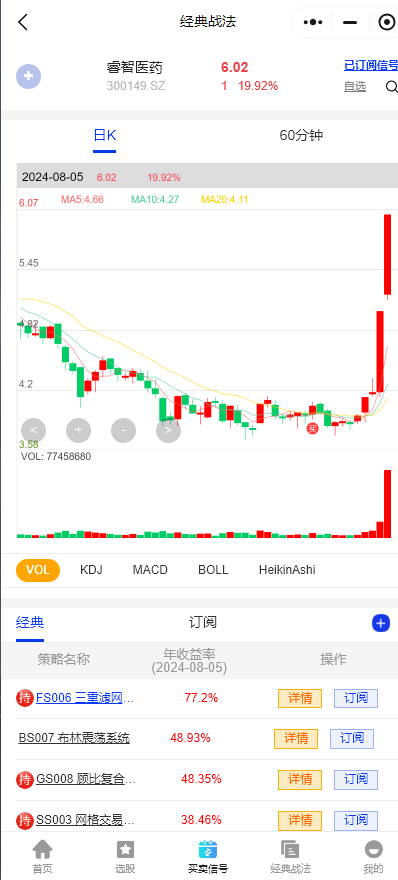
$睿智医药(SZ300149)$:1.益生元行业龙头,主打低聚果糖、低聚半乳糖为代表的益生元产品,主要服务客户为乳品、保健品行业。 2.公司是一家拥有领先水平的生物药、化学药一站式医药研发及生产外包服务提供商,主营业务包含两大业务板块,分别为医药研发及生产服务(CRO/CDMO)、微生态营养与医疗。
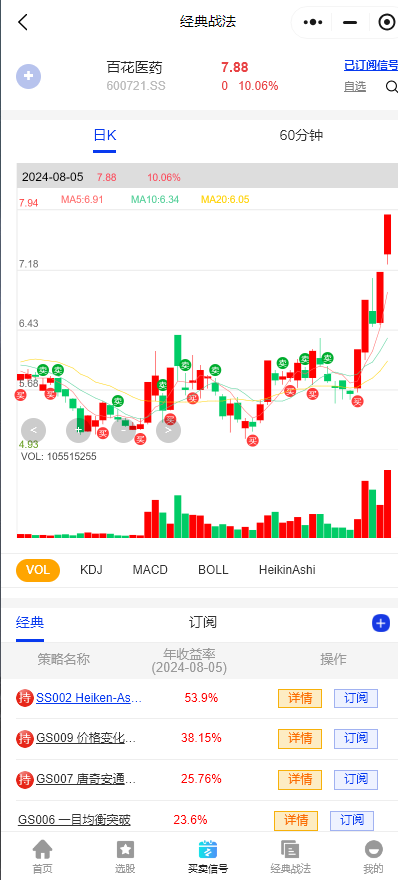
$百花医药(SH600721)$:公司主营业务为药物发现、研究、技术服务,提供从药物发现、CMC、临床CRO、药品注册、CMO/API供应等新药开发全流程的服务及一体化的解决方案。 2.全资子公司华威医药可以为客户提供利拉鲁肽注射液及司美鲁肽注射液的相关药品研发服务。
$鲁抗医药(SH600789)$:公司是抗生素龙头,青霉素系列、半合抗系列产品品种较为齐全,覆盖了原料药到制剂的大部分品种,形成了从发酵原料到半合成原料药再到制剂的完整产品链。
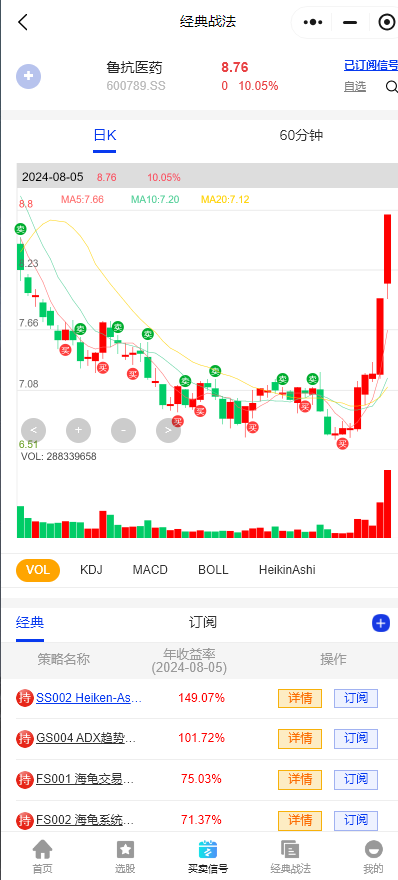
注:以上仅为谱数的经典战法数据统计结果,供大家参考,股市有风险投资需谨慎。
本文作者可以追加内容哦 !

