来源:器械之家,未经授权不得转载,且24小时后方可转载。
近日,FDA向除颤器电池制造商Amco发出警告信,称其为飞利浦(Philips)、史赛克(Stryker)和卓尔(Zoll)等公司销售的自动体外除颤器(AED)所提供的电池是未经批准的违规设备。
FDA指出,Amco公司在未能寻求上市前批准(PMA)后继续供应电池。根据2015年最终确定的修改,电池和其他AED配件制造商需要在2022年2月初提交PMA。
资料显示,Amco在通信、数据收集、电子、军事、运输和便携式医疗设备等多个领域均有所布局,是提供完整电源解决方案的领导者。此前,该公司网站显示其医疗部分,为Cardiac Science、Philips、Physio-Control 和 Zoll 等品牌的AED提供电池,但目前其医学页面是空白的。
AED作为一种便携式的医疗设备,可以通过电击的方式,在极短的时间内放出大量电流经过心脏,以终止心脏不规律、不协调的电活动,使心脏恢复搏动,成倍提高抢救成功率。
从构成来看,目前的AED通常由主机、电极贴片和显示屏组成。主机是控制和传输电能的核心,电极贴片用于粘贴在患者胸部,而显示屏则提供指导信息。
01
Amco的AED电池未经PMA批准
2015年2月,FDA公布了AED检测心电图和进行电击所需要配件的最终条令。根据最终条令,电池和垫电极等其他设备制造商有90天时间提交PMA。
不过,在满足某些条件的情况下,FDA决定在15个月内不对已上市的AED执行PMA要求。同时FDA还同意将必要AED配件的PMA提交要求的执行推迟到2020年2月执行。到了2020年,由于新冠疫情等原因,FDA要求相关企业在2022年2月之前提交必要配件的PMA。
FDA检查员在3月份访问了Amco在纽约的工厂。检查显示,该公司生产用于AED系统的电池,包括Cardiac Science公司的 Powerheart G3、几款飞利浦产品和Physio-Control公司的Lifepak 1000。需要指出的是,Physio-Control于2016年被史赛克收购,Cardiac Science于2019年被卓尔公司收购。
根据 FDA的说法,Amco未能在 2022年2月的截止日期前提交 PMA,但仍继续制造和分销这些设备。因此,根据美国法律,FDA认为这些设备是掺假的。FDA要求Amco“停止导致必要的AED配件掺假的活动”,并立即采取行动解决警告中确定的违规行为。
FDA在信上注明的日期是6月25日。Amco在收到这封信后有15个工作日的时间发送一份书面清单,列出为解决违规行为而采取的措施,并解释其计划如何防止问题再次发生。
02
AED技术发展历程
自动体外除颤仪,简称AED,是一种便携式的医疗设备,它可以通过电击的方式,在极短的时间内放出大量电流经过心脏,以终止心脏不规律、不协调的电活动,使心脏恢复搏动,成倍提高抢救成功率。
纵观AED的发展历史,从胸内到体外,从交流电到直流电,技术的每一步跨越都凝聚着人类智慧的火花和对生命的无限敬畏。
1947年,克劳德·贝克(Claude Beck)以其非凡的创造力和勇气,成功发明了第一台心内除颤器,开启了心脏复苏的新纪元;1956年,保罗·卓尔(Paul Zoll)紧随其后,发明了第一台体外除颤器;1960年,伯纳德·洛恩(Bernard Lown)以其卓越的才华和远见,发明了世界上第一台直流电除颤器。这一突破性的发明,不仅大幅提升了心脏复苏的成功率,也为心脏除颤技术的未来发展开辟了新的道路。
现代意义上的自动体外除颤器(AED)的诞生并非归功于英国的心脏病专家弗兰克·潘特里奇(Frank Pantridge),而是来自美国俄勒冈州波特兰市的外科医生阿彻迪亚克博士(Arch Diack)在20世纪70年代初的杰出成就。
1982年,美国食品药品监督管理局(FDA)批准了AED的临床试验,并在20世纪80年代中期正式批准其上市销售,使得受过训练的非专业人士也能使用这一设备,极大地扩展了AED的应用范围。
随着时间的推移,AED的设计和功能不断得到改进。现代AED配备了引导程序和自动语音提示,使用方便的电极片,能够自动检测心脏节律并在必要时指示操作者进行电击。从1982年FDA批准的临床试验,到1990年代初第一响应人的成功使用,再到2000年工作场所健康和安全标准的推广,AED的应用逐渐普及。
2002年,飞利浦的Heart Start AED作为处方被批准在家庭使用,2003年纽约州成为第一个在学校强制安装AED的州;2004年,美国联邦航空管理局(FAA)要求所有美国航空公司客机必须配置AED,同年FDA批准AED作为非处方器械向家庭销售。随后,公众除颤(PAD)计划在全球范围内得到推广,使得AED成为学校、体育场、机场、车站等公共场所的标准配置,为心脏骤停患者提供了宝贵的生命保障。
03
中国AED市场潜力巨大
中国国家心血管病中心统计数据显示,我国每年心源性猝死者高达55万人,平均每天1500人死于心脏骤停,每分钟就有1个人因为心脏骤停突然倒地,这些意外87%发生在医院外。
AED作为能够诊断特定的心律失常,并且给予电击除颤,是可被非专业人员使用的用于抢救心脏骤停患者的医疗设备,是目前公认抢救心脏骤停患者的“救命神器”。
但需要指出的是,长期以来AED在我国的配置率过低,每10万人口AED配备数量不足2台,而《中国AED布局与投放专家共识》2020年中的数据,美国和日本平均每10万人拥有700台和276台。
从政策端来看,自从《健康中国行动(2019—2030年)》明确提出在人员密集场所配备自动体外除颤器(AED)后,全国各地纷纷出台相关政策,大力推广和普及AED的配置和使用,AED市场需求呈现出爆发性增长的态势。
据前瞻产业研究院预测,2026年中国AED行业市场规模将达到29.2亿元左右。按照100-200台/10万人的AED配置标准,我国AED配置应达到140-280万台,市场规模超500亿元,达到国际标准后,更将突破千亿大关。
04
国内AED厂商发力追赶
目前,国产厂商在AED领域的不断突破,为国内市场的健康发展做出了贡献。在国产AED尚未出现前,国内市场被飞利浦、卓尔、日本光电等国外品牌所占据,且设备单价在4~9万元左右,高昂的售价也在某种程度上阻碍了AED的普及。
2013年,迈瑞医疗研发出我国首台国产AED并投放市场,宣布了国产品牌在AED领域零的突破。随着AED市场的增长,包括迈瑞、鱼跃、久心、维伟思、科曼、瑞新康达等国产企业开始发力,加大了投资和研发的力度,逐步打破进口垄断,实现国产替代。
据MDCLOUD(医械数据云)统计,截至今年4月,该数据库共收集184条体外除设备中标数据,涉及130家采购单位和16个品牌商。
从中标品牌情况看,迈瑞中标金额排名第一,占比61.04%;科曼中标金额排名第二,占比16.31%;卓尔排名第三,占比5.6%。
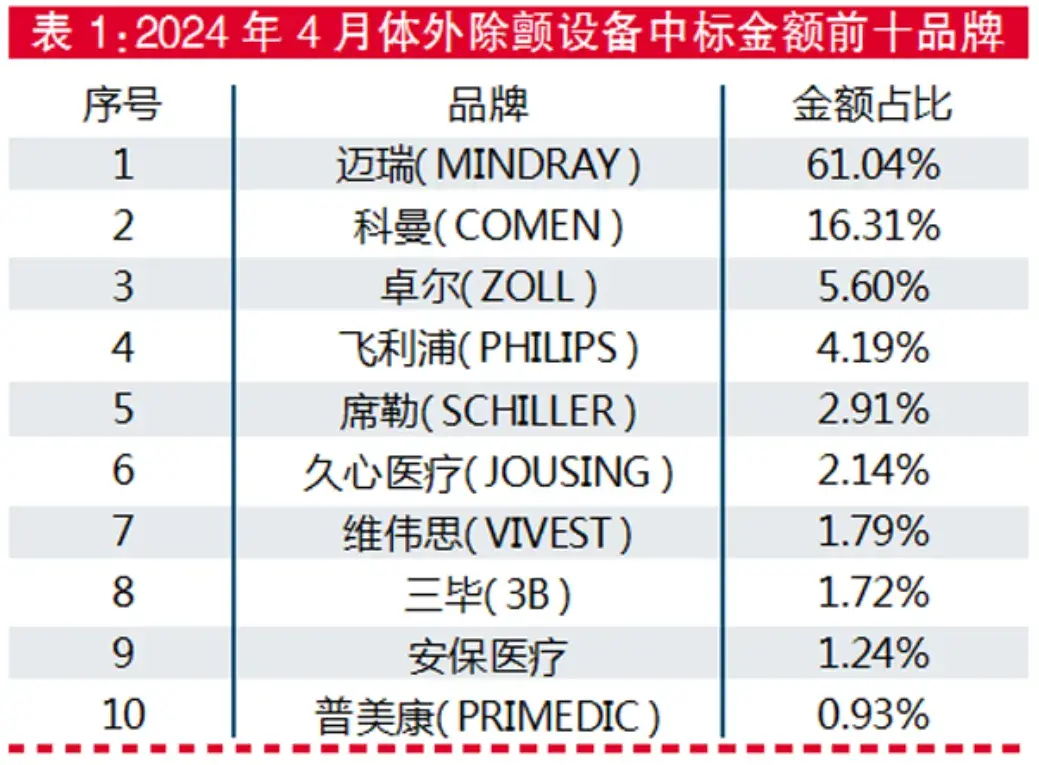
数据来源:MDCLOUD(医械数据云)
需要指出的是,在本次FDA发布的警告中,涉及了史赛克、飞利浦、卓尔等三家公司的AED电池。那么,接下来,上述企业又将作出何种应对措施?其在中国的AED产品是否会受到影响?器械之家将持续关注。
本文作者可以追加内容哦 !

