
后浪森林研究室|出品
资料整理及写作|Luoke
编辑|罗周 统筹、编辑助理|许佳维
2023年3月7日。礼来的SolanezumabIII期宣布失败。这是全球医药研究史阿尔茨海默症(AD)的152次失败。AD被称为“脑海中的橡皮擦”——思维、记忆和独立性受损,关于它的药物则素有“研发黑洞”之称。
随后的11月7日。礼来另一条路线的DonanemabIII期获得成功,还有一款Remternetug处于研发进程中。
这是礼来死磕阿尔茨海默的二十年,投入的研发成本超过50亿美元。

阿尔茨海默症,是礼来医药研发史上的一个不可忽略的符号。这也是它成为全球第一医药市值公司核心价值的一部分。
失败与成功都非同寻常,这亦成为类似礼来的全球企业的重大使命与重大价值所在。他们的尊敬来自于挑战,以及来自于思考全人类的难题。
如果你要更完整的理解礼来,“成长企业常识”在此之前分别发表了《礼来说明了什么?》、《礼来的秘密,“me better”》、《王炸级产品,近看礼来的替尔泊肽》,这将对你的阅读带来帮助。
“阿尔茨海默”
“痴呆”一语源于法国医师、被誉为现代精神医学之父的菲利普·皮内尔(Philippe Pinel)定义。1906年,德国医生阿洛伊斯·阿尔茨海默(Alois Alzheimer)发现了痴呆的一种最常见类型,与其老师德国精神病学家、现代精神病学创始人埃米尔·克雷佩林(Emil Kraepelin),将此病命名为阿尔茨海默病AD。
AD是与家族遗传和年龄增长相关的一种神经退行性疾病,其主要症状有:从短期记忆受损发展到记忆力丧失,语言、感觉、运动技巧变差,情绪不稳定,最后病人会变得没有反应、失去活动能力和身体功能的控制能力,终至死亡。
1864年6月14日,阿尔茨海默出生于德国维尔茨堡南部的小镇马克特布赖特(Marktbreit)。1883年从阿莎芬堡(Aschaffenburg)高中毕业后进入柏林大学医学院学习,随后就读于图宾根大学、维尔茨堡大学。1887年,阿尔茨海默最终在维尔茨堡大学获医学博士学位,论文题目是《关于耳垢腺的研究》(On the Earwax Glands)。
阿尔茨海默工作分为法兰克福、慕尼黑和布雷斯劳三个阶段。
1888年,他到法兰克福精神病院并工作了14年,期间与弗朗茨·尼氏(Franz Nissl,1860年~1919年)合作出版了6卷本《大脑皮层的组织学与组织病理学》。
1903年,又到慕尼黑大学精神病系工作,第二年发表了《进行性麻痹组织学研究的鉴别诊断》;1906年,利用显微镜研究一位患者的脑组织标本,发现大量老年斑和神经纤维缠结。
1912年,阿尔茨海默应邀前往布雷斯劳(Breslau,现波兰弗罗茨瓦夫)大学精神病与神经病研究所,担任所长和心理学教授,因途中患病感染,1915年12月19日逝世,终年51岁。
阿尔茨海默仅次于心脏病、肿瘤和中风而导致死亡的第四大疾病,已成为人类目前和未来所面临的全球公共卫生和社会保健的最大挑战之一。2015年,全球AD患者为4680万人,预计2030年将达到7 470万人。2015年中国AD患者数量达到950万人,每年以5%~7%的速度增长。
关于AD全面的生化研究开始于20世纪60年代末和70年代初,学界公认的三大病理特征是:淀粉样蛋白(amyloid -protein,A)沉积、神经纤维缠结和神经元大量丢失 。A是核心,也是AD发病的关键性因素和近年来被普遍认为的治疗靶点。
起源与进程:礼来死磕二十年
2023年3月8日,礼来宣布停止其阿尔茨海默病药物“Solanezumab”开发。该药物的III期A4临床发现,接受Solanezumab治疗的患者阿尔茨海默病认知综合征评分下降1.69分,安慰剂组平均下降1.4分, 差异无统计学意义。
礼来称,“ Solanezumab并未清除淀粉样蛋白斑块或阻止淀粉样蛋白积聚。”主流观点认为,AD病因是-淀粉样蛋白(A)和Tau蛋白沉积造成。因此,清除这两种蛋白的不正常聚集或可解决AD治疗难题。
这就宣告,礼来的“Solanezumab”路线失败了。
最初Solanezumab的实施计划由圣路易斯华盛顿大学研究人员和礼来公司在2000年代初在小鼠身上测试的一种实验药物,研究人员发现该药物能够在小鼠身上通过结合并完全隔离血浆A来减少大脑的A负荷。
礼来关于AD的研发始于2002年,开始阿尔茨海默病药物Solanezumab研发,这是一种针对可溶性-淀粉样蛋白的单克隆抗体。
十年之后的2012年, Solanezumab3期临床试验失败。结果显示,Solanezumab未能改善轻度和中度阿尔茨海默病患者的记忆力及认知功能。
礼来制药研发阿尔茨海默病药物未因此而停歇。2013年,礼来公司的科学家们仔细研究了这些数据,并基于许多临床研究所针对患者的疾病进展可能过晚的证据,再次启动了“史无前例的二级预防试验”——A4研究。在大脑中已出现-淀粉样蛋白斑块但尚未出现症状的早期阿尔茨海默病患者身上测试Solanezumab,共1100名患者接受Solanezumab或安慰剂治疗4.5年。
A4研究招募了美国、日本、加拿大和澳大利亚等67个地点的1100多名年龄在65至85岁的参与者,这些人依据PET扫描结果,在大脑中存在A斑块积聚但尚未出现阿尔兹海默病症状。A4研究希望测试solanezumab能否在4.5年内减缓这些人与阿尔茨海默病相关的认知能力下降、脑成像和其他生物标志物的进展。
该研究最早设定的主要终点是认知功能+生活自理能力。2016年3月,礼来以“新的科学证据”为由中途修改研究的复合终点,仅保留“认知能力”作为主要终点,将“生活自理能力”调整为次要终点。然而,患者接受每4周1次400mg的Solanezumab治疗76周后,轻度AD患者的认知能力并没有显著提高。
2016年11月,备受关注的礼来solanezumab靶向-淀粉样蛋白(A)的阿尔茨海默症药物试验失败。礼来此时已在此款新药研发投入超过了30亿美元,宣告失败对礼来打击非常巨大。消息一出,礼来股价立即下跌了16%。此后,更是裁员485人为此次失败买单。
今年3月8日,礼来制药宣布,Solanezumab未能清除或阻止-淀粉样蛋白斑块积聚,也没能减缓阿尔茨海默病早期患者的认知能力下降,该临床试验未能达到主要终点。礼来制药随即宣布停止Solanezumab的开发。
这项进行了20多年的研发项目最终以失败告终。
礼来公司药物和全球品牌开发负责人John Sims在声明中说:“A4 研究终结了我们对 solanezumab 的临床开发,并表明利用这种机制靶向可溶性A在该人群中是无效的。”但他还表示,“虽然这项研究的结果是负面的,但产生的独特数据增加了我们对临床前阿尔茨海默病的理解,并将推进下一代阿尔茨海默病的预防研究。”
A4研究的项目总监、哈佛医学院布莱根妇女医院的神经学家、医学博士Reisa Sperling则认为:“(A4的)结果表明,A是阿尔茨海默病临床前阶段认知能力下降的关键驱动因素。即使在疾病非常早期的阶段,也需要更加积极地去除A。”
礼来表示:“虽然这项研究结果是负面的,但产生的独特数据增加了我们对临床前阿尔茨海默病的理解,并推进AD预防研究。”
值得赞颂的是,礼来坦然面对了这一失败成果,并在一个月后,它的另一款阿尔茨海默症药物Donanemab启动了一项IIIb期研究,并随后获得成功,这抵消了solanezumab 研发失败所带来的影响。
三条路径探索: Solanezumab、Donanemab和Remternetug
事实上,礼来除solanezumab外,还有donanemab、semagacestat、lanabecestat和remternetug等几款AD药物同步探索。
2010年8月,semagacestat研发失败,该药物未能延缓阿尔茨海默症的进展,并且与部分临床指标的恶化相关。2018年,礼来又停止与阿斯利康联合开发的口服分泌酶裂解酶(BACE)抑制剂lanabecestatⅢ期临床。
多次失败让礼来汲取了更多经验,之后的donanemab和remternetug则专门针对沉积的淀粉样蛋白,并已被证明可清除淀粉样斑块。这两款药物进展顺利。
2023年1月16日,中国国家药监局药品审评中心(CDE)公示,礼来公司的1类新药remternetug注射液获得临床试验默示许可,拟开发治疗早期阿尔茨海默病。此次remternetug在中国获批临床,意味着该产品在中国进入临床研究阶段。
显著的是礼来Donanemab和Remternetug两个研发产品。
Donanemab研发过程也极为曲折,它的二期临床试验入组患者仅有94人,而FDA要求礼来提供至少100名接受过12个月持续治疗的患者数据,也因此被拒绝了该药在美国的加速批准。
然而结果显示,Donanemab在18个月内将某些早期阿尔茨海默病患者的认知和功能下降速度减缓了35%。
而Leqembi 的3期关键临床试验数据显示,它在18个月内使阿尔茨海默病患者的认知和功能下降速度减缓了27%。Leqembi每两周给药一次,Donanemab每四周给药一次。
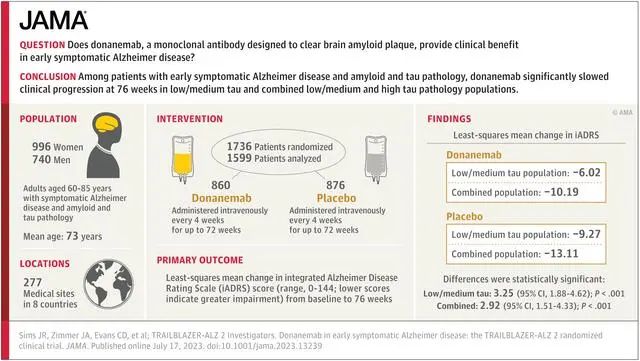
在礼来3期试验TRAILBLAZER-ALZ 2中,Donanemab对处于疾病早期阶段的试验参与者更有益,与安慰剂受试者相比,接受Donanemab治疗的受试者认知和功能的下降减缓了 60%,临床痴呆评定量表(CDR-SB)显示,患者认知能力衰退减缓了46%。
Donanemab的表现和参与者的年龄有关,在75岁以下的人群中,阿尔茨海默病综合评分量表(iADRS)显示临床衰退速度减缓了48%,CDR-SB减缓了45%;而对于75岁或以上的参与者,这两个数字分别为25%和29%。
美国时间2023年7月17日,礼来宣布其已向美国食品药品监督管理局(FDA)提交了阿尔茨海默病新药Donanemab的上市申请,FDA预计2023年年底前做出决定。此外,礼来正在向其他全球监管机构提交文件,其中大部分将在年底前完成。如果获得全面批准,Donanemab将成为继日本卫材药业(Eisai)和美国渤健公司(Biogen)联合开发的Leqembi(通用名:Lecanemab)之后的第二个“里程碑”。
7月初,FDA完全批准Leqembi上市。
2023年5月份,礼来宣布donanemab达到了试验的所有目标。在1182名患有早期阿尔茨海默病的患者中,与安慰剂相比,donanemab能够将患者临床衰退速度减缓35%,患者日常自理能力下降速度减缓40%,近半数患者接受donanemab治疗后1年内疾病未出现进展。
美国东部时间2023年11月6日,全球市值最高药企礼来首席科学家丹尼尔·斯科沃隆斯基(Daniel Skovronsky)“极度乐观”地表示,“阿尔茨海默病的一个重大突破即将到来,donanemab这种药物将可能成为下一个类似减肥药(GLP-1)的热点。”
过去几个月以来,全球医学界一直在等待FDA对donanemab的审批。
斯科沃隆斯基是礼来首席科学家和首席医疗官,向来是药物创新领域的先驱。斯科沃隆斯基早在1998年就发表了对该领域的研究,当时他还在宾夕法尼亚大学医学院,他随后还创办了一家名为Avid radiopharmacticals的公司并开发了一种诊断试剂,帮助评估阿尔茨海默氏症患者。
斯科沃隆斯基说道:“这实际上是我毕生的工作。”
斯科沃隆斯基称,donanemab延缓阿尔茨海默病的效果“真的非常显著”。他说,近一半接受donanemab治疗的患者在一年后没有丧失任何认知能力,这“意义重大”。
此外,礼来还在开发一种口服的分泌酶裂解酶(BACE)抑制剂,名为E2609。这种药物可以通过抑制BACE酶的活性,减少淀粉样蛋白的生成,从而防止或延缓阿尔茨海默病的发展。该药物目前正在进行3期临床试验,招募了全球约2100名早期阿尔茨海默病患者。
全球同行者:罗氏、辉瑞、强生、渤健与卫材,前沿研发探索者
后浪森林研究室相信,包括礼来在内的全球同行者罗氏、辉瑞、强生、渤健及卫材,这些企业阿尔茨海默症方面的探索历程,都是一本厚厚的探索。他们都是值得尊敬的企业。

2012年,辉瑞、强生宣布停止阿尔茨海默病药物Bapinuezumab的研发。
2017年,默沙东宣布终止用于攻克阿尔茨海默症的新药Verubecestat的临床Ⅲ期试验。
2018年6月,礼来宣布与阿斯利康停止口服分泌酶裂解酶抑制剂Lanabecestat治疗阿尔茨海默病的全球III期临床试验。
2018年,辉瑞宣布结束当时正在进行中的神经学类疾病研究项目,主要集中在阿尔茨海默症及帕金森症的潜伏期、I 期、II 期的早期临床试验中。
2018年,强生公司也宣布由于安全原因放弃另一种BACE抑制剂的试验。
2022年6月,罗氏的阿尔茨海默病药物Crenezumab在阿尔茨海默病预防倡议(API)项目中的II期临床也未达到主要研究终点。
2022年11月,罗氏的另一款阿尔茨海默病药物Gantenerumab在全球3期临床Graduate 1和2的两项研究中均未达到主要目标。其消除的淀粉样蛋白比研究人员预期的要少,且结果在统计学上并不显著。
阿尔茨海默病一直被称为医药研发届的“天坑”,研发失败率高达99.6%,仅为其他药业成功率的1/8。
连续的临床失败并没有让各药企停下攻克阿尔茨海默病的脚步。目前全球有5款药物处于阿尔茨海默病适应症上市申请状态,81款药物处于临床三期状态。
2021年6月7日,美国FDA批准渤健的单抗药物阿杜那单抗(aducanumab)上市,这是自2003年以来,FDA批准的首个阿尔兹海默症治疗新药,也是首个能阻止疾病进展的药物。
但这个药获批后引发了巨大争议,因为有报道称FDA神经科学部门主管Billy Dunn与渤健私下有密切联系,后来多名FDA评审专家辞职抗议,Billy Dunn也于2023年2月底离职。
2023年1月,渤健与卫材联合开发的新药Lecanemab获得美国FDA的加速批准上市。其3临床试验结果显示,在18个月的时间里,接受Lecanemab治疗的患者的认知能力下降速度比未接受该治疗的患者慢27%。
由于在今年先后传出突破性进展,礼来制药的Donanemab和渤健Lecanemab成为当下最热门的阿尔茨海默病药物。
“脑海中的橡皮擦”阿尔茨海默病终于有了新药!
礼来新药的上市意味着什么?对比之前FDA获批的一款药物,礼来VS渤健,两家企业未来在AD领域的PK谁会更有竞争力?

从技术路径看,两者都是靶向淀粉样蛋白。
从临床数据来看:
有效性:礼来Donanemab在综合数据面板上高于渤健/卫材Lecanemab约2%;
安全性:礼来Donanemab的ARIA-E(淀粉样蛋白相关影像学水肿)在治疗组中的发生率为24%;渤健/卫材Lecanemab的ARIA-E在治疗组中发生率为12.5%。
从药价来看:
渤健/卫材Leqembi(lecanemab)定价为每年2.65万美元。
礼来虽未公布Donanemab定价,但美国临床与经济评价研究所(ICER)表示要使Donanemab具有成本效益需要定价在每年1.45万美元-4.69万美元之间。
对于中国市场进展:
渤健/卫材Leqembi(lecanemab)已在中国申报上市,等待获批;
礼来Donanemab也已在中国进行国际多中心III期临床研究,以评估其治疗早期症状性阿尔茨海默病的安全性和有效性。
关于阿尔茨海默症,诸多研发还在路上,当前我们所看到的只是阶段性成果。
突破“研发黑洞”:华尔街分析师预测礼来2035年收入1000亿美元
2021年9月21日世界卫生组织发布的《公共卫生领域应对痴呆症全球状况报告》,目前有超过5500万人(65岁以上的人群中,8.1%的女性和5.4%的男性)患有痴呆症,预计到2030年将上升到7800万人,到2050年时则将达到1.39亿人。与此同时,全世界每年诊断出新发痴呆症病例为1000万,即每3.2秒钟就会新增一个病例。
阿尔茨海默病药物则素有“研发黑洞”之称。
礼来在研发上的投入并不少。近日Fiercebiotech发布的“2022年全球制药企业研发投入10强”,礼来以71.9亿美元投入排名第8。
不过,礼来营收在PharmExec发布的“2022年全球制药企业TOP50榜单”,礼来排在第13位(与第10名GSK相差约74亿美元),渤健第24。
而2023年,礼来或手握三款“流量密码”:Mounjaro、Donanemab、Tirzepatide。
GLP-1/GIP双激动剂Mounjaro:是目前礼来已经在售的一款“减肥神药”。据礼来2022年财报显示,Mounjaro上市不到一年销售额已达4.83亿美元。分析师预计其2023年销售额将达近20亿美元,2030年销售额可达300亿美元。
Donanemab、Tirzepatide:是2022年Evaluate Vantage预测未来最具潜力新药前二;且都有望在2023年获批。
阿尔兹海默药Donanemab排名第一。
同为减肥神药的Tirzepatide排第二。
华尔街分析师预计,如果其适应症都获批,到2035年,其年总销售额可能高达1000亿美元。
这便是礼来。
所有的预测在被市场真实验证之前都要打个问号。
$礼来(NYSE|LLY)$$罗氏(ADR)(OTCBB|RHHBY)$#阿兹海默症治疗有重大突破?#
本文作者可以追加内容哦 !

